Ewolucja waleni
Ewolucja waleni – historia przemian ewolucyjnych ssaków z grupy waleni. Rozpoczęła się ona na subkontynencie indyjskim, gdzie walenie powstały z parzystokopytnych. Walenie stanowią w pełni przystosowane do środowiska wodnego ssaki morskie należące do grupy parzystokopytnych, z których wydzieliły się około 50 milionów lat temu. Wyewoluowały w eocenie bądź jeszcze wcześniej. Ich najbliższymi współczesnymi krewnymi są hipopotamowate. Jako ssaki muszą wynurzać się na powierzchnię w celu zaczerpnięcia oddechu, mają w płetwach po 5 kości palców rąk, opiekują się młodymi i pomimo w pełni wodnego trybu życia zachowały liczne cechy szkieletu swych lądowych przodków. Odkrycia, począwszy od dokonanych w latach 70. XX wieku w Pakistanie, ujawniły kolejne etapy przejścia waleni z lądu do morza.

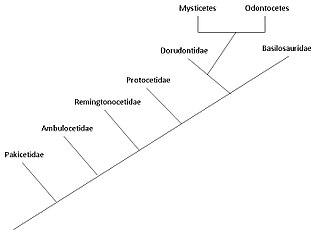
Fiszbinowce i zębowce oddzieliły się od siebie co najmniej 36,5 miliona lat temu, podczas drugiej radiacji waleni (pierwsza dotyczyła prawaleni). Adaptacja w postaci echolokacji u zębowców odróżnia je od w pełni wodnych prawaleni i Mammalodontidae, wczesnych fiszbinowców. Obecność fiszbin pojawiała się stopniowo u fiszbinowców. Wczesne formy miały bardzo mało fiszbin, ich wielkość wiąże się z ich rolą i wzrostem udziału filtracji w żywieniu się.
Konwergencja
edytujWalenie stanowią dobry przykład trudności, jakie może nieść za sobą odtwarzanie pokrewieństw między organizmami. Istnieje kilka różnych metod odtwarzania filogenezy i budowy drzew obrazujących rozdzielanie się linii ewolucyjnych, generalnie jednak opierają się one o analizę wspólnych cech łączących organizmy. Obecność wspólnych cech świadczyć ma o wspólnym pochodzeniu danego zbioru organizmów, a więc o tworzeniu przez nie grupy monofiletycznej. Jednak nie wszystkie cechy jednakowo nadają się do tego celu. Walenie mają wiele cech wspólnych z rybami. Z drugiej strony mają jeszcze więcej cech wspólnych ze ssakami lądowymi (np. budowę układu krwionośnego). Powstaje pytanie, czy należy zaliczyć je do ssaków, czy do ryb. W sytuacji konkurencyjnych hipotez zazwyczaj wybiera się prostszą, czyli wymagającą mniej założeń (w tym przypadku mniej zdarzeń ewolucyjnych). W tym wypadku prostsze jest rozwiązanie sytuujące walenie wśród ssaków (zaliczenie waleni do ryb wymagałoby założenia o dwukrotnym powstaniu na drodze ewolucji choćby złożonego serca ssaków)[2]. Pozostaje jednak do wyjaśnienia duża liczba cech łączących walenie z innymi zwierzętami wodnymi, nie tylko rybami, ale też np. ichtiozaurami. I u waleni, i u ichtiozaurów występowały płetwy – rozwinęły się one jednak u tych grup niezależnie. Zjawisko takie nazywane jest konwergencją[3], natomiast wspólne cechy pomimo odmiennego pochodzenia zwane są homoplastycznymi[4]. Wyrażają one adaptację organizmów o różnym pochodzeniu do podobnych warunków środowiskowych[5]. Badania molekularne wskazały na hipopotamowate jako na najbliższych współczesnych krewnych waleni. Wyniki te odzwierciedla pogląd o przynależności waleni do rzędu parzystokopytnych[6][7]. O ile u hipopotamowatych obserwuje się już pewne adaptacje do wodnego trybu życia, walenie są znacznie bardziej zaawansowane ewolucyjnie. Spośród innych ssaków walenie pod względem morfologii najbardziej przypominają syreny, jednak i w tym przypadku nie świadczy to o bliskim pokrewieństwie, ale stanowi wyraz ewolucji równoległej[7]. Przykłady tej ostatniej odnaleźć można także w obrębie grupy waleni. Przykładowo Cephalorhynchus z rodziny delfinowatych przystosował się do przybrzeżnych siedlisk półkuli południowej, morfologią i wielkością przypominając morświnowate, inny delfinowaty Australodelphis przywodził z kolei na myśl zyfiowate. Ewolucja waleni nie przebiegała jednak jednokierunkowo. Odobenocetops podobny był do dzisiejszych morsów[8].
Powstanie waleni stanowi jeden z najlepszych przykładów makroewolucji świetnie udokumentowanej zapisem kopalnym, w przeciwieństwie do wielu innych wcześniejszych powrotów kręgowców lądowych do wody, np. ichtiozaurów. Z drugiej strony transformacji ewolucyjnej waleni, bynajmniej nie jednokierunkowej, towarzyszyły głębokie zmiany ekologiczne[8].
Pochodzenie
edytujNajbardziej pierwotne walenie pochodzą z terenów dzisiejszego Pakistanu, z eocenu[9].
Dawne walenie zalicza się do wymarłego parworzędu prawaleni (Archaeoceti). Obecnie grupę taką uważa się jednak za parafiletyczną[10].
W przeszłości uważano, że walenie pochodzą od drapieżnych. Tradycyjna teoria ewolucji waleni została zaproponowana po raz pierwszy[9] przez Van Valena w 1966. Van Valen widział w waleniach potomków Mesonychidae, z których miały się one wyodrębnić w paleocenie[11]. Mesonychia przypominały ssaki drapieżne uzębieniem i budową czaszki, z wysokim grzebieniem strzałkowym, wąską puszką mózgową i podobnymi łukami jarzmowymi. Niekiedy nawet zaliczano je do rzędu drapieżnych, dopiero w latach sześćdziesiątych spostrzeżono liczne różnice, w szczególności zaś kopyta wieńczące palce mezonychów. Niekiedy zaliczano je do kreodontów (np. Gregory w 1910), teraz znów do prakopytnych (przeniósł je Van Valen w 1966). Tak czy inaczej odkrycie Pakicetus uczyniło hipotezę wywodzącą walenie od mezonychów bardziej prawdopodobną. Jego uzębienie przypominało zęby mezonychów. Jednego z Pakicetidae, Ichthyolestes, uważano nawet niegdyś za mezonycha[9].
Z drugiej strony rosła ilość danych wskazujących na związki waleni i parzystokopytnych. O ich bliskim pokrewieństwie świadczyły dane paleontologiczne, morfologiczne, embriologiczne i molekularne[12]. Przykładowo wymieniano choćby mechanizm erekcji prącia, 3 oskrzela główne, ułożenie kości śródstopia[13]. Rewolucję wywołały jednak badania z zakresu genetyki. Graur I Higgins opisali w 1994 badania opierające się o 5 sekwencji mtDNA i 11 sekwencji DNA jądrowego, kodującego białka. Wyniki wskazały na znacznie bliższą relację waleni i parzystokopytnych, niż to podejrzewano wcześniej. Okazało się, że walenie wykazują znacznie więcej podobieństw w stosunku do bydła domowego, niż do świni czy wielbłąda, ale – co więcej – że bydło domowe jest bliżej spokrewnione z waleniem niż ze świnią czy wielbłądem[12]. W tym samym roku Irwin i Árnason opublikowali swoje badania cytochromu b. Doszli dzięki nim do podobnych wniosków, wskazali też hipopotamowate jako najbliższych krewnych waleni[14]. Z obu prac wypływają podobne wnioski: dawny pogląd uznające walenie za bliskich krewnych parzystokopytnych stracił na aktualności. Walenie okazały się nie tylko być jedną z grup parzystokopytnych, lokującymi się blisko przeżuwaczy[12], a nawet w ich obrębie[14]. Graur i Higgins dostrzegli konieczność uwzględnienia nowych faktów w systematyce. Zaproponowali uznać walenie za podrząd parzystokopytnych, ewentualnie podnieść pozostałe podrzędy parzystokopytnych do rangi niezależnych rzędów[12]. W 1996 Gatesy et al. potwierdził ich wyniki, posiłkując się badaniem genów kodujących kazeinę. Tak więc walenie i hipopotamowate byłyby grupami siostrzanymi, a pozbawione waleni parzystokopytne stanowiłyby takson parafiletyczny. Gatesy i współpracownicy nie nadali nowemu kladowi nazwy, określając go w sposób opisowy jako Cetacea/Hippopotamidae[13]. W kolejnym roku w pracy autorstwa Montgelard et al pojawiła się nazwa Cetartiodactyla, mająca oznaczać parzystokopytne wraz z waleniami[15]. Nazwę tę (stworzoną ze słów walenie, Cetacea, i parzystokopytne, Artiodactyla) zaproponowano na określenie rzędu, obejmującego zarówno walenie, jak i parzystokopytne[16]. Propozycja ta nie spotkała się z uznaniem, gdyż zgodnie z taką definicją termin ten oznaczałby dokładnie to samo, co parzystokopytne w nowym rozumieniu[17]. Tymczasem bliskie pokrewieństwo między waleniami i hipopotamowatymi potwierdzały kolejne badania[18].
Dane molekularne wsparło odkrycie Pakicetus, najwcześniejszego z prawaleni. Szkielet tego zwierzęcia zaprzecza bezpośredniemu pochodzeniu waleni od Mesonychia. Zamiast tego świadczy o istnieniu parzystokopytnych, które zaczęły wchodzić do wody niedługo po oddzieleniu się Mesonychia od parzystokopytnych. Prawalenie zachowały pewne aspekty ich pokrewieństwa z Mesonychia, jak trójgraniaste zęby, które utraciły współczesne parzystokopytne i walenie. Przodkowie wszystkich kopytnych byli przynajmniej częściowo mięsożercami, być może padlinożercami, a dzisiejsze parzystokopytne oraz nieparzystokopytne wykształciły roślinożerność w późniejszym etapie ewolucji. W odróżnieniu od nich walenie zachowały mięsożerność, gdyż zwierzęca zdobycz była łatwiej dostępna oraz dostarczała więcej energii, co było ważne dla stałocieplnych ssaków morskich. Mesonychia także stały się wyspecjalizowanymi mięsożercami, ale to obróciło się przeciw nim, gdyż duża zdobycz nie trafiała się często. Być może dlatego zostały wyparte przez lepiej zaadaptowane ssaki, takie jak hienodonty i drapieżne[16].
Wraz z kolejnymi badaniami systematyka ssaków ulegała zmianom, coraz bardziej uwzględniając filogenezę tej grupy. Biorąc pod uwagę nowo przedstawioną wiedzę, Weddel i współpracownicy zdecydowali się nadać nazwy nowym kladom, czego dokonali w swej publikacji z 1999. Oparli się oni o relacje, które przedstawić można następującym kladogramem[19]:
| Artiofabula |
| ||||||||||||||||||
Widać tam klad tworzony przez walenie i hipopotamowate (zaznaczony barwą lazurową). Klad ten, o definicji Cetacea + Hippopotamidae, określili nazwą Whippomorpha. Stanowi ona zlatynizowaną wersję określenia użytego wcześniej nieformalnie w innej pracy, autorstwa Gatesy'ego i współpracowników sprzed 3 lat. Ponadto klad powstały z połączenia tychże Whippomorpha i przeżuwaczy (Ruminantia) nazwali Cetruminantia (zaznaczono na zielono). Klad tworzony przez rzeczone Cetruminantia i świniowate ochrzczono mianem Artiofabula (zaznaczono na żółto). Wszystkie 3 zdefiniowane w ten sposób nowe klady stanowią grupy koronne[19].
Wczesna ewolucja
edytujIndohyus
edytujIndohyus był małym zwierzęciem, przypominającym kanczylowate, żyjącym około 48 milionów lat temu na terenie dzisiejszego Kaszmiru[21]. Zaliczono go do parzystokopytnych, rodziny Raoellidae, i uważa się go za najbliższą grupę zewnętrzną waleni. Indohyus uznany został za parzystokopytnego z powodu jego anatomii kości skokowej (tzw. trochlea hinges)[20], charakterystycznej dla tej grupy. To wszystkożerne stworzenie wielkości szopa bądź kota domowego dzieliło wiele cech ze współczesnymi waleniami. Szczególnie należy wymienić tutaj involucrum, rozrost kostny stanowiący cechę diagnostyczną waleni, niespotykany u innych gatunków[1]. Wykazywał także adaptacje do wodnego trybu życia, jak gęste kości kończyn redukujące wyporność, umożliwiające zwierzęciu przebywanie pod wodą. Podobne adaptacje widać u współczesnych ssaków wodnych, takich jak hipopotam[22][23]. Sugeruje to podobną strategię przetrwania, obserwowaną u afrykańskich kanczylowatych, jak np. wodnokanczyl afrykański. W razie zagrożenia ze strony ptaków drapieżnych zwierzę to nurkuje w wodzie i kryje się pod jej powierzchnią na czas do czterech minut[24].
Pakicetidae
edytujPakicetidae były palcochodnymi ssakami kopytnymi, które uznaje się za najwcześniejsze znane walenie; Indohyus zaś stanowi najbliższą grupę zewnętrzną[21][25]. Żyły we wczesnym eocenie, około 50 milionów lat temu. Ich skamieniałości po raz pierwszy odkryto w północnym Pakistanie w 1979. Znajdowały się nad rzeką niedaleko brzegów dawnego Oceanu Tetydy[26]. Po tym pierwszym odkryciu znaleziono więcej szczątków, głównie w osadach rzecznych wczesnego eocenu z północy Pakistanu i północnego zachodu Indii. Na podstawie tych odkryć stwierdzono, że Pakicetidae najprawdopodobniej żyły w suchych siedliskach efemerycznych strumieni i umiarkowanie rozwiniętych terenów zalewowych[1]. Analizy stabilnych izotopów tlenu wykazały, że piły one wodę słodką, co oznacza, że żyły wokół zbiorników słodkowodnych[27]. Ich pokarm stanowiły prawdopodobnie spragnione zwierzęta lądowe, które zbliżały się do wody, bądź pewne organizmy słodkowodne żyjące w rzece[1]. Wydłużone kręgi szyjne i cztery połączone ze sobą kręgi krzyżowe wyglądają jak u innych parzystokopytnych, co czyni Pakicetus jedną z najwcześniejszych odkrytych skamielin z okresu po rozdzieleniu się linii waleni i reszty parzystokopytnych[28].
Pakicetidae klasyfikuje się jako walenie w związku z budową części bębenkowej kości skroniowej, tworzonej wyłącznie przez ectotympanicum. Kształt okolicy ucha u Pakicetidae wydaje się niezwykły. Czaszka przypomina te należące do waleni, ale nie ma jeszcze obecnego typowego dla wielorybów nozdrza. Żuchwa nie posiada dużego i wypełnionego tłuszczem otworu żuchwowego, którego współczesne walenie używają do odbierania dźwięków pod wodą[29]. Oczodoły są położone grzbietowo, podobnie jak u krokodyli. Takie ułożenie oczu pomaga zanurzonemu pod wodą drapieżnikowi obserwować potencjalną zdobycz nad wodą[27]. Wedle badania z 2009 zęby pakicetydów także przypominają zęby kopalnych wielorybów, mniej zaś przywodzą na myśl kły psa. Ząbkowane trójgraniaste zęby również łączą je ze współczesnymi waleniami[30]. Początkowo myślano, że uszy Pakicetidae zaadaptowane były do słyszenia pod wodą, jak można by oczekiwać, sądząc po anatomii reszty ciała; jednak uszy pakicetydów wyspecjalizowane były w słuchaniu na lądzie[31]. Niemniej zwierzęta te potrafiły słyszeć pod wodą, ale raczej z użyciem bardziej wzmocnionego przewodzenia kostnego niż błony bębenkowej, jak u ssaków lądowych. Ta metoda nie zapewnia jednak kierunkowego słuchu pod wodą[29].
Pakicetidae miały długie, cienkie kończyny o względnie krótkich dłoniach i stopach, co sugeruje, że kiepsko pływały[1]. By skompensować ten brak, ich kości są niezwykle grube (osteosklerotyczne), co prawdopodobnie stanowi adaptację czyniącą zwierzę cięższym, by przeciwdziałać wypierającej je wodzie[20]. Zgodnie z badaniem morfologicznym autorstwa Thewissena i in. z 2001 pakicetydy nie wykazywały adaptacji szkieletu do środowiska wodnego, zamiast tego znaleziono adaptacje do biegu i skakania. Wobec tego ssaki te raczej chodziły w wodzie[31].
W rodzinie tej umieszcza się takie rodzaje, jak Pakicetus, Nalacetus, Ichthyolestes. Zwierzęta te niekiedy uważa się nie za osobną rodzinę, ale podrodzinę w obrębie Protocetidae[9].
Ambulocetidae
edytujAmbulocetidae to rodzina prawaleni (niekiedy uznawana za podrodzinę w obrębie Protocetidae), do której należą: Ambulocetus, Himalayacetus i Gandakasia[9]. Ambulocetus żył około 49 milionów lat temu. Odkryto go w Pakistanie w 1994. Ze swymi dużymi szczęką i żuchwą przypominał nieco krokodyle z grupy Brevirostres. W eocenie ambulocetydy zamieszkiwały zatoki i estuaria Oceanu Tetydy na terenach, które współcześnie są północnym Pakistanem. Ich skamieliny znajdywane są w przybrzeżnych płytkomorskich osadach z cechami obfitej morskiej roślinności i mięczaków strefy litoralu[1]. Choć znajdowane jedynie w osadach morskich, ich iloraz izotopowy tlenu wskazuje, że połykały zakres wody o zróżnicowanej zawartości soli mineralnych. Niektóre osobniki w ogóle nie wykazują oznak konsumpcji wody morskiej, inne wcale nie połykały wody słodkiej w czasie odkładania się substancji w ich zębach. Jest jasne, że ambulocetydy tolerowały szeroki zakres stężenia soli mineralnych. W związku z tym reprezentują one fazę przejściową pomiędzy siedliskiem słodkowodnym i morskim[27].
Otwór żuchwowy Ambulocetidae powiększył się, co wskazuje na magazynowanie tam tłuszczu. U współczesnych zębowców ta poduszka tłuszczowa z otworu żuchwowego biegnie do tyłu do ucha środkowego. Umożliwia to odbiór dźwięków za pomocą żuchwy i ich transmisję poduszką tłuszczową do ucha środkowego. Podobnie do pakicetydów, oczodoły ambulocetydów leżały na szczycie czaszki, ale bardziej bocznie niż u Pakicetidae[27].
Ambulocetidae miały względnie długie kończyny, szczególnie silne były ich tylne łapy. Zachowały też ogon bez śladu płetwy[26]. Budowa ich kończyn tylnych wskazuje na przydatność do poruszania się po lądzie znacznie ograniczoną w porównaniu ze współczesnymi ssakami lądowymi. Prawdopodobnie ambulocetydy w ogóle nie wychodziły na ląd. Budowa szkieletu kolana i stawu skokowego wskazuje na ograniczenie ruchomości tylnych kończyn do jednej płaszczyzny. Sugeruje to, że na lądzie wyrzut tylnych kończyn zapewniałyby mięśnie grzbietu[32]. Prawdopodobnie pływały one dzięki ruchom miednicy (ten sposób pływania wykorzystuje głównie kończyny tylne, generujące napęd w wodzie) i falowaniu ogona (sposób pływania wykorzystujący głównie falowanie kręgosłupa), jak wydra, płetwonogie i współczesne wieloryby[33]. Jest to pośredni etap ewolucji typowego dla waleni pływania, współczesne ich przedstawiciele płyną dzięki oscylacjom ogona (sposób pływania podobny do falowania ogona, ale wydajniejszy energetycznie)[27].
Badania z 2016 wykazują, że Ambulocetidae były w pełni wodnymi zwierzętami jak współczesne walenie; cechowały się podobną morfologią tułowia i nie byłyby zdolne do utrzymania na lądzie masy ciała. Sugeruje to, że całkowite opuszczenie lądów wydarzyć się musiało wcześniej na drodze ewolucyjnej waleni, niż uprzednio sądzono[34].
Remingtonocetidae
edytujRemingtonocetidae żyły w środkowym eocenie w Azji Południowej około 49–43 miliony lat temu[35]. W porównaniu z rodzinami Pakicetidae i Ambulocetidae Remingtonocetidae to zróżnicowana rodzina zwierząt, których szczątki znajdywano w północnym i środkowym Pakistanie oraz w zachodnich Indiach. Remingtonocetidae również znajdowano w osadach płytkomorskich, były jednak w oczywisty sposób bardziej morskie niż ambulocetydy. Widać to w odkryciach ich szczątków w osadach o zróżnicowanych siedliskach brzegowych, w tym przybrzeżnych i lagunowych[1]. Wedle analizy stabilnych izotopów tlenu większość z Remingtonocetidae nie połykała wody słodkiej. Utraciły one swą zależność od wody słodkiej względnie niedługo po powstaniu[27]. Do grupy tej zaliczają się: Remingtonocetus, Andrewsiphius, Attockicetus, Dalanistes i Kutchicetus[9].
Remingtocetus porównywany jest do gawiala[8]. Oczodoły Remingtonocetidae, niewielkiej wielkości, patrzyły w bok. Sugeruje to, że widzenie nie stanowiło najważniejszego ze zmysłów tych ssaków. Otwór nosowy, w końcu przybierający postać pojedynczego nozdrza współczesnych wielorybów, lokował się w okolicy czubka pyska. Jego lokalizacja nie zmieniła się od czasów pakicetydów[27]. Zwracającą uwagę cechą Remingtonocetidae były kanały półkoliste, ważne w utrzymaniu równowagi u zwierząt lądowych, które były zmniejszone[36]. Redukcja ich wielkości blisko współgrała z radiacją waleni w środowiskach morskich. Zgodnie z badaniem z 2002 autorstwa Spoor i in. modyfikacja kanałów półkolistych może reprezentować kluczowy punkt ewolucji waleni, poza którym nie było już możliwości przedłużonej fazy ziemno-wodnej[36].
W porównaniu z Ambulocetidae Remingtonocetidae miały względnie krótkie kończyny[27]. Na podstawie szczątków szkieletu stwierdza się, że były prawdopodobnie ziemno-wodnymi waleniami, dobrze zaadaptowanymi do pływania, i to prawdopodobnie pływania tylko dzięki undulacjom (falowaniu) ogona[1].
Protocetidae
edytujProtocetidae tworzą zróżnicowaną i heterogeniczną grupę[1]. Obecnie uważa się je za parafiletyczne[37][38].
Żyły w eocenie, około 48–35 milionów lat temu. W środkowym eocenie osiągnęły bardzo szerokie rozmieszczenie geograficzne: były znane z Azji, Europy, Afryki i Ameryki Północnej. Prawdopodobnie zasiedlały głównie przybrzeżne laguny i wody oblewające archipelagi[8], choć inaczej niż u poprzednich rodzin waleni, ich skamieliny z Afryki czy Ameryki Północnej obejmują również formy pełnomorskie. Ich skamieniałe pozostałości odkryto w brzegowych i lagunowych facjach Azji Południowej[1]. Prowadziły prawdopodobnie ziemno-wodny, ale bardziej wodny niż Remingtonocetidae tryb życia[35]. Protocetidae był pierwszymi waleniami, które opuściły subkontynent indyjski i rozprzestrzeniły się na wszystkie płytkie podzwrotnikowe oceany świata[27].
Rodzina ta obejmuje podrodzinę Georgiacetinae[38]. Wiele rodzajów zalicza się do Protocetidae. Rozwinęły wielką różnorodność adaptacji do życia w wodzie, aczkolwiek niektóre z nich potrafiłyby unieść swe ciało na lądzie, podczas gdy inne nie byłyby w stanie[1]. Ich domniemana ziemnowodna natura wspierana jest odkryciem ciężarnej Maiacetus, której skamieniały płód przyjął już położenie główkowe, wskazując na to, że Maiacetus rodziły się na lądzie. Gdyby przychodziły na świat w wodzie, płód wydostawałby się z macicy ogonem do przodu, by uniknąć utonięcia w czasie porodu[39]. Tak więc zwierzęta te potrafiły wychodzić na ląd, choćby tylko po to, by wydać na świat dziecko[37].
W przeciwieństwie do Remingtonocetidae i Ambulocetidae Protocetidae miały duże oczodoły zorientowane bocznie. Coraz bardziej skierowane bocznie oczy mogły służyć obserwacji podwodnej zdobyczy. Przypominają one oczy współczesnych waleni. Co więcej, otwory nosowe były duże i ulokowane w połowie pyska. Wielka różnorodność zębów sugeruje zróżnicowane sposoby żywienia się Protocetidae[35]. U Remingtonocetidae i Protocetidae wielkość otworu żuchwowego wzrastała[27]. Duży otwór żuchwowy wskazuje na obecność żuchwowej poduszki tłuszczowej. Wypełnione powietrzem zatoki obecne u współczesnych waleni, izolujące ucho akustycznie, by lepiej słyszeć pod wodą, jeszcze się nie wykształciły. Przewód słuchowy zewnętrzny, nieobecny u dzisiejszych waleni, także jeszcze istniał[29]. Przewód ślimaka łączył w sobie cechy lądowych parzystokopytnych i bardziej zaawansowanych waleni. Słyszały dźwięki o wyższej częstotliwości, niż ich lądowi przodkowie[37]. Tak więc sposób transmisji dźwięków łączył w sobie cechy spotykane u pakicetydów oraz współczesnych zębowców. Na tym pośrednim etapie rozwoju słuchu transmisja dźwięków z powietrza była słaba z powodu modyfikacji ucha dostosowujących je do słyszenia pod wodą, natomiast kierunkowy słuch pod wodą również był słaby w porównaniu ze zdolnościami dzisiejszych waleni[29]. Nie komunikowały się one pod wodą infradźwiękami na znaczne odległości (prawdopodobnie żyły w siedliskach przybrzeżnych). Jednakże zwierzęta te słyszały i w wodzie, i w powietrzu, stanowiąc formy przejściowe w ewolucji słuchu waleni[37].
Pewne Protocetidae miały krótkie, szerokie przednie i tylne łapy, które prawdopodobnie służyły im do pływania, ale też zapewniały powolne i niezgrabne przemieszczanie się na lądzie[27]. Możliwe, że niektóre Protocetidae miały płetwy ogonowe i jest jasne, że lepiej zaadaptowały się do wodnego stylu życia. Przykładowo u Rodhocetus kość krzyżowa, u ssaków lądowych powstająca w wyniku fuzji pięciu kręgów krzyżowych i łącząca miednicę z resztą kręgosłupa, podzieliła się na wolne kręgi. Jednak miednica cały czas łączyła się z jednym z nich. Pozostałością po kopytnych przodkach waleni są kopytka wieńczące palce Rodhocetus[40].
Budowa stopy Rodhocetus wskazuje na przede wszystkim wody tryb życia Protocetidae. Praca opublikowana w 2001 przez Gingericha i in. zawierała hipotezę, wedle której Rodhocetus poruszał się w środowisku oceanicznym w podobny sposób jak Ambulocetidae – oprócz falujących ruchów ogona wykonywał wiosłujące ruchy miednicą. Przemieszczanie się Rodhocetus po lądzie było bardzo ograniczone z powodu budowy tylnych kończyn. Uważa się, że poruszał się podobnie jak uchatkowate, rotując tylne płetwy do przodu i ustawiając je pod ciałem[41]. Żywiły się, polując w wodzie[37].
Basilosauridae
edytujNie istnieje pełna zgoda co do wzajemnej relacji między Basilosaurinae i Dorudontidae/Dorudontinae. Większość badaczy klasyfikuje je w tej samej rodzinie (Basilosauridae), możliwe jednak, że jest ona parafiletyczna[7][42]. W takim wypadku zasadne może być uznawanie Dorudontinae za osobną rodzinę, jak uczynili na przykład Thewissen i współpracownicy[31]. Większość autorów zalicza jednak Dorudontinae do Basilosauridae jako podrodzinę, obok drugiej podrodziny Basilosaurinae[35]. Poza tymi dwiema grupami Hong-Yan i Xi-Jun do Basilosauridae zaliczają także Stromeriinae[9]. Z kolei klad łączący Basilosauridae i Neoceti (grupa obejmująca współczesne walenie) określana jest mianem Pelagiceti. Nazwę tę ukuł Mark D. Uhen w 2008[38].
Basilosaurinae i Dorudontinae żyły obok siebie w późnym eocenie około 41–35 milionów lat temu. Stanowią one najstarsze znane obligatoryjnie wodne walenie[31]. W pełni uznaje się za wieloryby. Żyły w oceanie. Pogląd ten wspierają ich skamieniałości znajdowane zazwyczaj w osadach wskazujących na siedlisko pełnomorskie, bez dopływu wody słodkiej[1]. Prawdopodobnie zamieszkiwały morza zwrotnikowe i podzwrotnikowe całego świata. Basilosaurinae często znajdowane są razem z Dorudontinae, były też ze sobą blisko spokrewnione[27]. Skamieniała zawartość żołądka jednego z Basilosauridae wskazuje na żywienie się rybami[1].
Choć wyglądały bardzo podobnie do współczesnych waleni, Basilosauridae nie miały zbudowanego z tłuszczu narządu o nazwie melon, służącego echolokacji. Miały też niewielkie mózgi. Sugeruje to samotnicze życie bez złożonej struktury społecznej, występującej u niektórych dzisiejszych waleni. Otwór żuchwowy Basilosauridae sięgał całej głębokości żuchwy jak u współczesnych waleni. Ich oczodoły kierowały się bocznie, a otwór nosowy przemieścił się jeszcze wyżej w obrębie pyska, bliżej miejsca, gdzie pojedyncze nozdrze znajduje się u dzisiejszych waleni[27]. Struktury ucha były funkcjonalnie współczesne, wraz z obecnością wypełnionych powietrzem zatok pomiędzy uchem a czaszką. Jednak w przeciwieństwie do współczesnych waleni u Basilosauridae zachował się duży kanał słuchowy zewnętrzny[29]. Natomiast niewielki ślimak przypomina spotykany u fiszbinowców. Podważa on możliwość dobrego słuchu w zakresie infradźwięków[37].
Basilosauridae miały szkielety łatwo rozpoznawane jako należące do waleni. Były też tak duże jak współczesne walenie. Przedstawiciele rodzajów takich jak bazylozaur osiągali długość dochodzącą do 18 m; Dorudontinae były mniejsze. Rodzaje takie jak Dorudon osiągały około 4,5 m długości. Wielkie rozmiary Basilosauridae wynikają z ekstremalnego wydłużenia kręgów lędźwiowych. Miały płetwę ogonową, ale proporcje ich ciał sugerują, że pływały przez undulacje ogona, a płetwa nie służyła tworzeniu napędu[1][43]. Z kolei Dorudontidae miały kręgosłup krótszy, ale mocniej zbudowany. Również miały płetwę ogonową i, w przeciwieństwie do Basilosauridae, prawdopodobnie pływały, podobnie do współczesnych waleni, z wykorzystaniem oscylacji ogona[27]. Kończyny przednie Basilosauridae miały prawdopodobnie kształt płetw, natomiast kończyny tylne były maleńkie i prawdopodobnie nie uczestniczyły w przemieszczaniu się[1]. Ich palce zachowały jednak ruchomość w stawach ich ambulocetowych krewnych. Dwie niewielkie, ale dobrze zbudowane tylne łapy Basilosauridae prawdopodobnie służyły przytrzymywaniu podczas kopulacji. Kości miedniczne związane z tylnymi kończynami nie łączyły się jednak z kręgosłupem, jak to miało miejsce u Protocetidae. Zasadniczo żaden z kręgów krzyżowych nie wyróżnia się szczególnie od innych[1][44]. Zwierzęta te żywiły się głównie rybami. Niektóre gatunki jednak mogły pożerać inne prawalenie[8].
Szkieletów bazylozaurydów odnajdywano na wszystkich kontynentach[8].
I Basilosaurinae, i Dorudontinae były względnie blisko spokrewnione ze współczesnymi waleniami, które zalicza się do podrzędów/parworzędów zębowców i fiszbinowców. Jednak wedle badania z 1994 autorstwa Fordyce'a i Barnesa duże rozmiary i wydłużone trzony kręgów Basilosauridae wykluczają je z grona kandydatów na przodków dzisiejszych form. Co do Dorudontidae, pewne gatunki w tej grupie nie miały wydłużonych trzonów kręgów, mogąc być przodkami zębowców i fiszbinowców. Inni przedstawiciele tych grup wyginęli[35].
Kekenodontidae
edytujKekenodontidae nie mają ustalonego miejsca na drzewie rodowym waleni. Bywają uznawane za prawalenie bądź zaliczane do fiszbinowców. Żyły w późnym oligocenie, 28-23 milionów lat temu[45].
Współczesne walenie
edytujUważa się, że oba wyróżniane podrzędy/parworzędy waleni – fiszbinowce i zębowce – oddzieliły się od siebie co najmniej 36,5 miliona lat temu podczas drugiej radiacji waleni (pierwsza dotyczyła prawaleni)[46][47]. Grupę obejmującą razem zębowce i fiszbinowce określa się terminem Neoceti. Powstała ona 38-39 milionów lat temu[47].
Fiszbinowce
edytujMarx i Fordyce dzielą ewolucję fiszbinowców na trzy fazy po powstaniu tej grupy przed 38 milionami lat. Pierwsza z nich, sprzed 36–30 milionów lat, obejmuje gwałtowną radiację adaptacyjną, druga, trwająca 30–23 milionów lat temu – powstanie fiszbinów, utratę zębów i w konsekwencji wykształcenie specyficznego sposobu odżywiania się poprzez filtrację, w końcu zaś przed 3–4 milionami lat różnorodność tych zwierząt spadła na skutek zmian klimatycznych[48]. Prawdopodobnie te same zmiany klimatu spowodowały niezależne powstanie gigantyzmu w kilku liniach ewolucyjnych fiszbinowców[49]. Ewolucja fiszbinowców zachodziła najszybciej na początku[48].
Marx i Fordyce po przeanalizowaniu 272 cech morfologicznych oraz 37646 genetycznych zaproponowali następujący kladogram[48] (uproszczono):
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Wyodrębnienie się fiszbinowców Marx i Fordyce wiążą z obniżeniem się temperatury w eocenie, w efekcie którego na przełomie eocenu i oligocenu doszło do zlodowacenia, w efekcie czego miał się uformować późniejszy Prąd Wiatrów Zachodnich. Z rozwojem prądów morskich zwiększyła się dostępność pokarmu[48]. Najstarszym znanym przedstawicielem grupy jest Mystacodon selenensis z górnoeoceńskich osadów w Peru[47]. Najwcześniejsze fiszbinowce miały zęby. Grupuje się je w dwie rodziny: Aetiocetidae i Mammalodontidae. Do żadnej z nich nie zalicza się jednak wspomnianego rodzaju Mystacodon, jak również rodzaju Llanocetus, stanowiącego grupę siostrzaną bezzębnych Chaeomysticeti[48]. Niekiedy są one klasyfikowane w monotypowych rodzinach Mystacodontidae i Llanocetidae[47][50]. Do uzębionych fiszbinowców zalicza się choćby Coronodon, którego szczątki znaleziono w skałach datowanych na oligocen. Zwierzęta takie prawdopodobnie odfiltrowywały z wody zdobycz za pomocą kołkowatych zębów, przywodząc na myśl dzisiejszego krabojada[51], bądź też żywiły się na sposób zębowców, drapieżnych płetwonogich bądź ssaków drapieżnych, na co wskazuje ostrość zębów policzkowych[52]. Jednakże już te pierwotne Mysticeti budową niektórych kości twarzoczaszki przypominały współczesne fiszbinowce z fiszbinami. Otwory odżywcze i bruzdy zdobiące ich podniebienia przywołują na myśl podobne struktury współczesnych fiszbinowców, związane z odżywianiem fiszbinów. Wydaje się, że na tym etapie ewolucji zęby i fiszbiny współistniały ze sobą. Struktury te nie są jednak homologiczne, fiszbiny powstają bowiem z wydzieliny nabłonka dziąseł. Są to struktury stale rosnące, ścierane od wewnątrz ruchami języka. Dzięki nim współczesne fiszbinowce odfiltrowują pokarm z wody, przepływającej między fiszbinami, na których zatrzymują się małe ryby lub bezkręgowce stanowiące zdobycz wieloryba[53]. Podział Llanocetus/Chaeomysticeti nastąpił 36,6 miliona lat temu, podczas chłodnego okresu, kiedy to zwiększył się trofizm wód Oceanu Południowego. Pierwsze bezzębne fiszbinowce, a więc przedstawiciele grupy Chaeomysticeti[48], znane nauce, to takie rodzaje jak Eomysticetus, Micromysticetus czy Mauicetus. Zwierzęta te żyły w późnym oligocenie. Zęby nie zachowały się również u żadnego ze współczesnych przedstawicieli grupy, biorąc pod uwagę dorosłe osobniki (zęby rozwijają się do pewnego stopnia w okresie życia wewnątrzmacicznego, nie wyrzynają się jednak i zanikają jeszcze przed porodem – osobnik w procesie ontogenezy przechodzi przez stadium zębów, następnie zębów i zawiązków fiszbin, na samych fiszbinach kończąc, spełniając zasadę rekapitulacji). Liczne badania filogenetyczne wskazują jednak na bardziej skokowe przejście opisanej transformacji[53]. Eomysticetus zalicza się obecnie do Eomysticetidae. Drugą wielką grupę bezzębnych Chaeomysticeti stanowi klad koronny fiszbinowców[48].
Konkretny sposób wykorzystania fiszbinów zależy od rodzaju. Sposób określany po angielsku mianem skim występuje w rodzinie walowatych. Pływacz szary zasysa bezkręgowce bentosu[53]. Odżywianie się tylu gulp występuje u płetwalowatych. Płetwal błękitny jednym haustem pobrać może nawet do 70 ton wody. Jednak same hausty (gulp) występują u nich także bez związku z odżywianiem się. Wymaga to specjalnych przystosowań, jak budowa spojenia żuchwy z udziałem tkanki chrzęstnej włóknistej, szerokiego stawu żuchwowego wtórnego, a także zmiany anatomii stosunków kości szczękowej i zębowej. Również gardło i tułów musiały się przystosować[54]. W przypadku żywienia się płetwalowatych (np. płetwala zwyczajnego) mówi się również o lunge feeding[55].
Filtrowanie pokarmu przynosi duże korzyści, pozwalając fiszbinowcom wydajnie wykorzystywać duże zasoby energii, co umożliwia im osiąganie wielkich rozmiarów ciała[53]. Rozwój filtracji może wynikać ze światowej zmiany klimatycznej i fizycznych zmian w oceanach. Wielkoskalowe zmiany prądów oceanicznych i temperatury mogły przyczynić się do radiacji współczesnych fiszbinowców[53]. Ich wcześniejsza grupa, „Archaeomysticetes”, do której zaliczały się Janjucetus i Mammalodon, miała bardzo małe fiszbiny i polegała głównie na swych zębach[56].
Zbadano również genetyczne podłoże utraty zębów przez walenie. Zidentyfikowano liczne mutacje genów, związanych z produkcją szkliwa u współczesnych fiszbinowców. Chodzi przede wszystkim o insercje/delecje skutkujące przedwczesnym pojawieniem się kodonów stop[53]. Postawiono hipotezę, zgodnie z którą mutacje te pojawiły się u waleni posiadających już pierwotne struktury fiszbinów, prowadząc do powstania pseudogenów z genów odpowiadających za produkcję szkliwa[57].
Ogólnie postuluje się, że 4 współczesne rodziny fiszbinowców mają odrębne pochodzenie wśród Cetotheriidae. Współczesne fiszbinowce: płetwalowate (płetwal, długopłetwiec), walowate (wal, waleń), pływaczowate (pływacz) i walenikowate (walenik) łączą zaawansowane ewolucyjnie cechy nieobserwowane dotychczas u żadnego Cetotheriidae i vice versa (przykład stanowi grzebień strzałkowy[58])[59].
Walowate są najbardziej bazalną z obecnych rodzin fiszbinowców. Wśród Chaeomysticeti wyróżnić można bowiem dwie główne grupy, z których jedną stanowią właśnie walowate. Drugą określa się mianem Plicogulae[48]. Termin ten stworzyli w 2011 Geisler, McGowen, Yang i Gatesy, obejmując nim płetwalowate, pływaczowate i walenika. Plicogulae liczą sobie minimum 7,2 miliona lat (a być może aż 11,6). Zaliczają bowiem do grupy "Megaptera" miocaena[60], zaliczanego wcześniej do płetwalowatych i umieszczanego w rodzaju Długopłetwiec oceaniczny przed rewizją zespołu Deméré'a w 2005. Zwierzę to znaleziono w skałach tortonu w Kalifornii[61]. Jest to grupa kontrowersyjna – niektóre badania (zwłaszcza genetyczne) potwierdzają jej monofiletyczne pochodzenie, podczas gdy inne (zwłaszcza morfologiczne) temu przeczą[48]. Np. w opisie Herpetocetus morrowi ich przedstawiciele leżą w różnych miejscach drzewa rodowego fiszbinowców, wraz z przedstawicielami Cetotheriidae[62]. Płetwalowate i pływaczowate okazują się w niektórych badaniach bliższe Cetotheriidae, niż walenikowi[63]. Plicogulae wyróżniają w swych pracach Gatesy i współpracownicy w 2013[7].
Plicogulae podzieliły się na dwie główne linie ewolucyjne około 28,96 miliona lat temu. Pierwszą z nich stanowią Cetotheriidae, które stanowią grupę monofiletyczną, jeśli zaliczyć do nich Neobaleninae. Zaliczają się tu też Herpetocetinae, takie jak Herpetocetus czy Nannocetus[48].
Drugą linię Plicogulae stanowią Balaenopteroidea. Zaliczają się doń pływaczowate i płetwalowate, a także inne, wymarłe już klady. W przeciwieństwie do innych rodzin w przypadku płetwalowatych dane morfologiczne nie zgadzają się z wynikami badań genetycznych[48]. Badania DNA mitochondrialnego sugerują włączenie do płetwalowatych pływacza. Do tej rodziny na pewno należy natomiast płetwal błękitny, uważany za największe zwierzę, jakie kiedykolwiek żyło[7].
3 miliony lat temu różnorodność fiszbinowców zaczęła się zmniejszać. Zanikły zwłaszcza formy osiągające mniejsze rozmiary, wśród których wymienia się: Balaenula, Balaenella, Herpetocetinae i niektóre płetwalowate. Mogło mieć na to wpływ zlodowacenie północnej półkuli, które wywarło piętno zwłaszcza na siedliska szelfowe, być może wymusiło też na waleniach dalsze migracje[48].
Zębowce
edytujKluczowym przystosowaniem w ewolucji zębowców wydaje się echolokacja, zdolność generowania i odbierania ultradźwięków. Zdolność taka pojawiała się nie raz w ewolucji czworonogów, ale zębowce są jedyną grupą wykorzystującą ultradźwięki w środowisku wodnym[8].
Adaptacja w postaci echolokacji pojawiła się, kiedy zębowce oddzieliły się od fiszbinowców, i odróżnia współczesne zębowce od w pełni wodnych prawaleni. Wydarzenie to nastąpiło około 34 milionów lat temu podczas drugiej radiacji ewolucyjnej waleni[64][65]. Ślady echolokacji obecną są nawet u najstarszych przedstawicieli grupy. Adaptacja ta powstała prawdopodobnie u początków radiacji zębowców, choć już wcześniej ewolucja postępowała w kierunku przystosowań do odbioru dźwięków o wyższych częstotliwościach. Przystosowania występowały już u ostatniego wspólnego przodka Zygorhiza i delfinów, jednakże linia prowadząca do Janjucetus i fiszbinowców ewoluowała dalej w innym kierunku, przystosowując się do wykorzystywania infradźwięków. Ostatni wspólny przodek delfinów i nowo opisanego w 2017 Echovenator słyszał już ultradźwięki. Sam późnooligoceński Echovenator miał prawdopodobnie worki powietrzne, a mięśnie jego twarzy przystosowane były do echolokacji. Cechował się też pewnymi szczegółami anatomii ucha wskazującymi na taką zdolność, choć zachowały się u niego jeszcze prymitywne cechy łączące go choćby z bazylozaurami, jak wielkość zwoju spiralnego[10].
W obrębie zębowców wyróżnia się klad Synrhina, obejmujący współczesne zębowce bez kogiowatych i kaszalotowatych[7].
Najlepiej poznanymi zębowcami epoki oligoceńskiej określa się niekiedy Squalodontidae. Ich pierwsze najstarsze skamieliny pochodzą z wczesnego oligocenu. Znaleziono je w Nowej Zelandii. W skałach środkowooligoceńskich znaleziono je w Niemczech. Natomiast późny oligocen reprezentują niemieckie, australijskie i nowozelandzkie. Wedle starszych publikacji (np. Whitmore i Sanders, 1976) żaden przedstawiciel rodziny nie przetrwał do miocenu[66]. Późnej jednak znaleziono szczątki przedstawicieli tej rodziny pochodzące z miocenu, np. w Grecji Squalodon cf. bellunensis. W nowszych pracach jako czas istnienia tej rodziny wskazuje się głównie późny oligocen i wczesny miocen[67].
Squalodon wykazuje kilka podobieństw do współczesnych zębowców: posiada znacznie skompresowaną czaszkę (co stwarza przestrzeń dla narządu zwanego melon w obrębie nosa), wydłużony pysk (rostrum) przekształcony w dziób, co dawało Squalodon charakterystyczny dla współczesnych zębowców wygląd. Jednak nie jest prawdopodobne, by Squalodontidae były bezpośrednimi przodkami współczesnych zębowców[68], jak to niegdyś zakładano. Okazuje się jednak, że Squalodontidae były pod pewnymi względami nawet bardziej zaawansowane ewolucyjnie, niż wczesne zębowce[67].
Squalodontidae zaliczają się do nadrodziny Platanistoidea, wraz ze Platanistidae i Squalodelphinidae. Te dwie ostatnie rodziny stanowią grupy siostrzane. Squalodelphinidae żyły w miocenie, jednym z pierwszych ich przedstawicieli jest wczesnomioceński Huaridelphis[69].
Zębowce straciły natomiast zmysł węchu[7].
Prócz Squalodontidae eoceńskie wody zamieszkiwały zębowce z rodzin Agorophiidae i Patriocetidae[66].
Współczesne zębowce nie polegają na zmyśle wzroku, ale raczej na swym sonarze podczas polowania. Echolokacja pozwala im także głębiej nurkować w poszukiwaniu zdobyczy, gdyż nie potrzebują już do nawigacji światła, dzięki czemu mogły otworzyć się na nowe źródła pokarmu[35][70].
Pierwsze oceaniczne delfiny takie jak Kentriodontidae wyewoluowały w środkowym oligocenie i zróżnicowały się znacznie w środkowym miocenie[42]. Pierwsze skamieniałości waleni z okolic płytkich mórz (gdzie żyją morświnowate) znalezione zostały w północnym Pacyfiku. Przedstawiciele rodzajów takich jak Semirostrum znajdowani byli wzdłuż Kalifornii, gdzie za czasów ich życia znajdowały się estuaria[71]. Zwierzęta te rozprzestrzeniły się na europejskie wybrzeża i półkulę południową później, w pliocenie[72]. Najwcześniejszym znanym przodkiem z linii narwalowatych jest Denebola brachycephala z późnego miocenu, około 10–9 milionów lat temu[73]. Pojedyncza skamieniałość z Półwyspu Kalifornijskiego wskazuje, że rodzina ta w przeszłości zasiedlała cieplejsze wody[35][74][75].
O ile dzisiaj kaszalotowate reprezentują pojedyncze gatunki, kiedyś była to zróżnicowana grupa. Pojawiła się ona w oligocenie[76]. Dawne kaszaloty różniły się od współczesnych liczbą zębów oraz kształtem twarzy, szczęki i żuchwy. Przykładowo Scaldicetus cechował się stępionym dziobem. Rodzaje oligoceńskie i mioceńskie miały zęby w szczęce. Te różnice anatomiczne sugerują, że te dawne gatunki nie musiały koniecznie polować na kalmary w głębinach morskich jak współczesne kaszaloty. Niektóre rodzaje mogły żywić się głównie rybami[35][77]. W przeciwieństwie do współczesnych przedstawicieli tej linii większość dawnych kaszalotów cechowała się budową umożliwiającą polowania na wieloryby. Livyatan, dzięki krótkiemu i szerokiemu dziobowi mierzącemu 3 m w przekroju, dysponował zdolnością do zadawania znacznych urazów wielkiej szamocącej się zdobyczy, jak inne wczesne wieloryby. Gatunki takie określa się zbiorczo angielskim terminem killer sperm whales[77][78]. Współczesne kaszaloty należą do największych drapieżników świata. Potrafią upolować wielkie kałamarnice, wstrzymując oddech na godzinę. Mają również największy ze wszystkich zwierząt mózg[7].
Zyfiowate obejmowały powyżej 20 rodzajów[79][80]. Polowały na nie prawdopodobnie kaszaloty i wielkie rekiny jak megalodon. W 2008 wielką liczbę skamieniałych zyfiowatych znaleziono na wybrzeżu Afryki Południowej, potwierdzając, że przetrwałe do dziś zyfiowate mogą być przedstawicielami bardziej różnorodnej niegdyś grupy. Po przestudiowaniu licznych skamieniałych czaszek badacze odkryli nieobecność funkcjonalnych zębów szczękowych u wszystkich południowoafrykańskich zyfiowatych, co stanowi dowód, że ssanie rozwinęło się już w kilku liniach zyfiowatych w miocenie. Wymarłe zyfiowate miały dobrze zbudowane czaszki, co sugeruje używanie ciosów w starciach między samcami[79].
Filogenezę zębowców przedstawia następujący kladogram autorstwa Churchill et al., autorów opisu Echovenator[10] (uproszczono):
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ewolucja szkieletu
edytujWspółczesne walenie mają wewnętrzne, szczątkowe kończyny tylne, cechujące się redukcją kości udowych, piszczelowych, strzałkowych i obręczy miednicznej. Indohyus miał pogrubioną część ectotympanicum tak jak u współczesnych waleni. Inną podobną cechą był skład zębów, zbudowanych głównie z fosforanu (V) wapnia, co koniecznie obserwuje się u zwierząt wodnych, jednak w przeciwieństwie do współczesnych waleni ich uzębienie było heterodontyczne (więcej niż jedna morfologia zęba), a nie homodontyczne (wszystkie zęby tej samej morfologii)[81]. Choć w pewnym sensie przypominały wilka, skamieniałości pakicetydów ukazują oczodoły położone znacznie bliżej szczytu czaszki niż u zwierząt lądowych; budową oka przypominać musiały walenie. Ich przejście z lądu do wody doprowadziło do zmiany kształtu czaszki i narządów obróbki pokarmu wskutek zmiany sposobu odżywiania się. Zmiana ułożenia oczu i kości kończyn uczyniła z Pakicetidae zwierzęta brodzące. Ambulocetidae także zaczęły wykształcać długie pyski, obserwowane u dzisiejszych waleni. Kończynami (i przypuszczalnie ruchami) przypominały wydry[82].
Brak kończyn waleni nie wynika z regresji w pełni wykształconych kończyn ani też z nieobecności zawiązków kończyn, stanowi raczej skutek zatrzymania ich rozwoju[83]. Zawiązki kończyn rozwijają się normalnie u zarodków waleni[22][84]. Osiągają w ten sposób fazę kondensacji wczesnej szkieletogenezy, kiedy to nerwy wrastają do zawiązków kończyn, zaś szczytowy brzeg ektodermalny (ang. apical ectodermal ridge, AER), struktura zapewniająca prawidłowy rozwój kończyny, wydaje się funkcjonować[83][84]. Okazjonalnie geny kodujące dłuższe kończyny doprowadzają do powstania u współczesnych waleni miniaturowych kończyn jako cechy atawistycznej[85].
Pakicetus cechował się miednicą podobną do miednic ssaków lądowych. U późniejszych gatunków, takich jak przedstawiciele bazylozaura, kość miedniczna była zredukowana i nie łączyła się już z kręgami i kością biodrową[81]. O odpowiedzialność za te zmiany podejrzewa się geny takie jak BMP7, PBX1, PBX2, PRRX1 i PRRX2[86]. Obręcz miedniczna współczesnych waleni została kiedyś uznana za strukturę szczątkową, niepełniącą żadnej funkcji. Jednakże u samca i samicy obręcz miedniczna osiąga różną wielkość, co stanowi wyraz dymorfizmu płciowego. Kości miedniczne dzisiejszego samca waleni są masywniejsze, dłuższe i większe, niż u płci przeciwnej. Najprawdopodobniej angażują się one w podtrzymywanie narządów rozrodczych zewnętrznych męskich, pozostających w ukryciu w ścianie brzucha nim dojdzie do reprodukcji[86][87][88].
Wczesne prawalenie w rodzaju pakiceta miały otwory nosowe umieszczone na końcu pyska, ale u późniejszych form takich jak Rodhocetus otwory te zaczęły przemieszczać się w kierunku szczytu czaszki. Po angielsku zjawisko to określa się terminem nasal drift[89]. Nozdrza współczesnych waleni uległy przekształceniu w strukturę zwaną blowhole, pozwalającą podpływać do powierzchni, robić wdech i zanurzać się dogodnie. Uszy również zaczęły przemieszczać się do wnętrza ciała. W przypadku bazylozaura ucho środkowe zaczęło odbierać wibracje z żuchwy. Współczesne zębowce wykorzystują strukturę zwaną melon, poduszkę z tłuszczu, do echolokacji[90].
Ewolucja w toku
edytujKultura
edytujKulturę stanowią specyficzne dla danej grupy zachowania przekazywane przez społeczne uczenie się. Przykładem kultury jest wykorzystywanie narzędzi podczas żerowania. Używanie ich bądź nie wpływa na zachowanie delfina podczas jedzenia, powoduje różnice w diecie. Ponadto wykorzystanie narzędzi pozwala na objęcie nowych nisz, polowanie na nową zdobycz. Różnice zachowania delfinów skutkują zróżnicowaniem przystosowania osobników w obrębie populacji, co w dłuższym czasie prowadzi do zmian ewolucyjnych[92]. Sieci kulturowe i społeczne odegrały już znaczną rolę w ewolucji współczesnych waleni; wniosek taki wypływa z badań ukazujących, że delfiny preferują parzenie się z osobnikami o takich samych wyuczonych społecznie zachowaniach, a długopłetwce śpiewają pieśni. Szczególnie w przypadku delfinów, największe niegenetyczne zmiany w ich ewolucji są skutkiem kultury i struktury społecznej[92].
Badanie z 2014 pokazało, że w populacji butlonosów z okolic Zatoki Rekina w Australii Zachodniej wyróżniają się dwie grupy zwierząt: wykorzystujące gąbki i nieczyniące z nich użytku. Pierwsze nakładały gąbkę na pysk jako środek ochronny przeciwko otarciom o ostre obiekty, haczykom jadowym płaszczek bądź innym jadowitym organizmom. Gąbki pomagały delfinom zdobyć ryby bez pęcherzy pławnych, jako że trudno je wykryć echolokacją przy złożonym tle. Butlonosy używające gąbek żerują szczególnie w głębokich kanałach, podczas gdy osobniki nieużywające gąbek żerują i w kanałach płytkich, i głębokich[93]. Opisane zachowanie przekazywane jest głównie przez matki dzieciom. Jako że jest to zachowanie grupowe przekazywane poprzez społeczne uczenie się, uznano je za cechę kulturową[92].
Badanie z 2014 z Zatoki Rekina odkryło różnice w wynikach analiz kwasów tłuszczowych populacji z Zatoki Zachodniej i Wschodniej, spowodowaną odmiennym źródłem pokarmu. Jednakże z porównania danych z samej Zatoki Zachodniej okazało się, że użytkownicy gąbek i żerujące w głębokich kanałach delfiny ich nieużytkujące znacznie różniły się kwasami tłuszczowymi, pomimo życia w tym samym siedlisku. Butlonosy stroniące od użytku gąbek z płytkich bądź głębokich kanałów miały wyniki zbliżone. Sugeruje to, że to używanie gąbek odpowiada za różnice w danych, a nie głębokość żerowania. Wykorzystanie gąbek otworzyło przed tymi delfinowatymi nową niszę, umożliwiając im polowanie na nową zdobycz, co spowodowało długofalowe zmiany w diecie. Zróżnicowanie źródeł jadłospisu w obrębie populacji zmniejszyło wewnątrzpopulacyjną konkurencję o zasoby. Zaszło tutaj zjawisko „rozejścia się cech” (ang. character displacement). W efekcie zwiększyła się pojemność środowiska, ponieważ cała populacja nie zależy już od tego samego źródła pokarmu. Zmieniły się również stopnie dostosowania w populacji, co umożliwia z kolei ewolucję kultury[93].
Struktura społeczna
edytujStrukturę społeczną tworzą grupy osobników wchodzących między sobą w interakcje, co skutkuje powstawaniem, przekazywaniem i ewolucją cech kulturowych. Relacje takie szczególnie widać w populacjach butlonosów południowo-zachodniej Australii, znanych z żebrania o rybę przed rybakami. Zachowanie to rozprzestrzeniło się w populacji dzięki uczeniu się indywidualnemu (delfinowate spędzające czas w pobliżu łodzi) i społecznemu (delfinowate spędzające czas z innymi delfinowatymi, wykazującymi żebracze zachowanie)[92].
Kultura może wpływać na strukturę społeczną, wywołując dopasowanie zachowań i określone dobieranie się w pary. Osobniki o pewnej kulturze z większym prawdopodobieństwem parzą się z osobnikami przejawiającymi te same zachowania niż z losowo wybranymi, co wpływa na grupę społeczną i strukturę społeczną. Przykładowo butlonosy używające gąbek w Zatoce Rekina preferują związki z osobnikami również używającymi gąbek[92]. Niektóre butlonosy z zatoki Moreton podążały za statkami krewetkowymi, żywiąc się odpadami, podczas gdy inne delfinowate z tej samej populacji tak nie postępowały. Zwierzęta te preferencyjnie gromadziły się z osobnikami zachowującymi się tak samo, mimo że wszystkie zamieszkiwały ten sam habitat. Później, gdy nie było już statków łowiących krewetki, delfinowate w ciągu kilku lat zintegrowały się w jedną sieć społeczną[92].
Sieci społeczne mogą wpływać na ewolucję, a nawet wywoływać ją poprzez wpływ na dostosowanie osobników[94]. Wedle badania z 2012 cielęta męskie miały mniejszą przeżywalność w razie silniejszych relacji z młodocianymi samcami. Jednak kiedy zbadano inne grupy wiekowo–płciowe, przeżywalność nie różniła się znacząco[95]. Sugeruje to, że młodociane samce wywierają stres społeczny na młodszych towarzyszy. Udokumentowano akty agresji, dominacji i zastraszania ze strony młodocianych samców przeciwko cielętom-samcom[95]. Zgodnie z badaniem z 2010 pewne populacje z Zatoki Rekina cechowały się różnicami w dostosowaniu i sukcesach rozrodczych. Różnice wynikały ze społecznego uczenia się (czy matka przekazała swą wiedzę na temat rozrodu cielętom) bądź silnego związku pomiędzy matkami w populacji. Zbierając się w grupy, poszczególne matki nie potrzebują być cały czas czujne wobec zagrożenia przez drapieżniki[94].
Badania genetyczne delfinków nadobnych, skupiające się na ich historii naturalnej, wykazały, że w rzeczywistości chodzi o wynik specjacji hybrydowej[96][97]. Krzyżowanie między delfinkiem długoszczękim i delfinkiem pręgobokim w północnym Atlantyku spowodowane było stałym zamieszkiwaniem przez oba gatunki wspólnego siedliska. Związki między tymi trzema gatunkami rozważano w oparciu o znaczące podobieństwa anatomiczne delfinków nadobnego i długoszczękiego, w efekcie czego ten pierwszy do 1981 był uznawany za podgatunek[98]. Możliwość, że delfinek nadobny jest krzyżówką delfinków długoszczękiego i pręgobokiego, zaczęła być rozważana dzięki podobieństwom anatomicznym i behawioralnym[99].
Czynniki środowiskowe
edytujSekwencjonowanie DNA w 2013 ujawniło, że w genomie baji chińskiego nie występuje polimorfizm pojedynczego nukleotydu. Po rekonstrukcji historii genomu tego gatunku badacze stwierdzili, że największy spadek różnorodności genetycznej został prawdopodobnie spowodowany efektem szyjki od butelki pod koniec ostatniego epizodu deglacjacji. W tym okresie poziom morza podniósł się, a globalne temperatury spadły. Inne historyczne zmiany klimatu również mogą korelować i wiązać się z historią genomu baji. Obrazuje to, jak globalne i lokalne zmiany klimatyczne mogą drastycznie wpływać na genom, prowadząc do zmian w dostosowaniu, przeżywalności i ewolucji gatunku[100].
Europejska populacja delfina zwyczajnego Morza Śródziemnego podzieliła się na wschodnią i zachodnią. Wedle badania z 2012 wydaje się to również stanowić efekt szyjki od butelki, który drastyczne zmniejszył liczebność wschodniej populacji śródziemnomorskiej. W badaniach Moury i współpracowników nie udało się wykryć struktury populacji, co wydaje się sprzeczne z wcześniejszymi badaniami opisującymi struktury populacji delfinów innych regionów[101]. Pomimo braku fizycznej bariery pomiędzy oboma regionami regionu śródziemnomorskiego u delfinów utrzymuje się podział na dwa typy pod względem ekologicznym i biologicznym. Wynika z tego, że różnice między populacją wschodnią i zachodnią najprawdopodobniej biorą się z silnej specjalizacji w wyborze niszy ekologicznej, a nie z bariery fizycznej. Środowisko odgrywa zatem wielką rolę w różnicowaniu i ewolucji gatunków delfinów[102].
Różnicowanie i specjacja butlonosów spowodowane zostały głównie zmianami klimatycznymi i środowiskowymi. Podziały w obrębie rodzaju korelują z okresami szybkich zmian klimatycznych. Przykładowo zmiany temperatur mogły wywołać zmiany linii brzegowych, pojawianie się wolnych nisz ekologicznych, pojawianie się możliwości oddzielenia się[103]. W północno-wschodnim Atlantyku dowody genetyczne szczególnie sugerują zróżnicowanie na dwa typy: delfiny bytujące wzdłuż linii brzegowej i pelagiczne. Różnicowanie wydaje się być spowodowane oddzielaniem się dużych grup, po którym oddzielone od siebie grupy zwierząt adaptują się odpowiednio i tworzą swe odrębne specjalizacje do zajmowanych nisz ekologicznych i struktur społecznych. Zróżnicowanie to spowodowało rozejście się dwóch grup i utrwalenie ich odrębności[104].
Dwie endemiczne, odrębne linie grindwala krótkopłetwego: większe, północne Tappanaga bądź Shiogondou i mniejsze, południowe Magondou, spotykane są w wodach archipelagu japońskiego. Uważa się, że lokalne wymarcie grindwala długopłetwego w północnym Pacyfiku w XII wieku mogło wywołać pojawienie się Tappanaga, powodując kolonizację przez grindwale krótkopłetwe zimniejszych okolic zasięgu grindwala długopłetwego[105][106]. Walenie przypominające wyglądem Tappanaga można także spotkać w okolicy Wyspy Vancouver i północnych wybrzeży USA[107].
Perspektywy
edytujW antropocenie na ewolucję waleni wpływa w znaczącym stopniu działalność ludzka, zwłaszcza polowania z użyciem techniki. Negatywny wpływ na walenie wywierają także wywołane przez człowieka zmiany klimatyczne, zmiana temperatury wody, kurczenie się lodu w okolicach polarnych. Na walenie wpływa również budowanie tam. W efekcie części gatunków waleni zagraża wyginięcie[8].
Przypisy
edytuj- ↑ a b c d e f g h i j k l m n o p q J.G.M. Thewissen, Williams, E. M. The Early Radiation of Cetacea (Mammalia): Evolutionary Pattern and Developmental Correlations. „Annual Review of Ecology and Systematics”. 33 (1), s. 73–90, 2002. DOI: 10.1146/annurev.ecolsys.33.020602.095426.
- ↑ Futuyma 2008 ↓, s. 25.
- ↑ Futuyma 2008 ↓, s. 50.
- ↑ Futuyma 2008 ↓, s. 51.
- ↑ Futuyma 2008 ↓, s. 52.
- ↑ Futuyma 2008 ↓, s. 78.
- ↑ a b c d e f g h John Gatesy, Jonathan H. Geisler, Joseph Chang, Carl Buell, Annalisa Berta, Robert W. Meredith, Mark S. Springer, Michael R. McGowen. A phylogenetic blueprint for a modern whale. „Molecular Phylogenetics and Evolution”. 66 (2), s. 479-506, 2013. Elsevier. (ang.).
- ↑ a b c d e f g h Nicholas D. Pyenson. The Ecological Rise of Whales Chronicled by the Fossil Record. „Current Biology”. 27, s. R558–R564, 2017. Elsevier. DOI: 10.1016/j.cub.2017.05.001. (ang.).
- ↑ a b c d e f g Gao Hong-Yan, Ni Xi-Jun. Diverse stem cetaceans and their phylogenetic relationships with mesonychids and artiodactyls. „Vertebrata PalAsiatica”. 53 (2), s. 153-176, 2015. [dostęp 2018-08-28]. (ang.). [patrz s. 165].
- ↑ a b c Morgan Churchill i inni, The Origin of High-Frequency Hearing in Whales, „Current Biology”, 26 (16), 2016, s. 2144–2149, DOI: 10.1016/j.cub.2016.06.004, PMID: 27498568.
- ↑ Leigh M. Van Valen. Deltatheridia, a new order of mammals. „Bulletin of the American Museum of Natural History”. 132, s. 1−126, 1966. (ang.).
- ↑ a b c d Dan Graur & Desmond G. Higgins. Molecular evidence for the inclusion of cetaceans within the order Artiodactyla.. „Molecular Biology and Evolution”. 11, s. 357-64, 1994. (ang.).
- ↑ a b John Gatesy, Cheryl Hayashi, Mathew A. Cronin & Peter Arctander. Evidence from milk casein genes that cetaceans are close relatives of hippopotamid artiodactyls. „Molecular Biology and Evolution”. 13, s. 954-63, 1996. (ang.).
- ↑ a b David M. Irwin, Úlfur Árnason. Cytochrome b gene of marine mammals: Phylogeny and evolution. „Journal of Mammalian Evolution”. 2, s. 37–55, 1994. Springer Link. (ang.).
- ↑ Claudine Montgelard, FranCois M. Catzejfis & Emmanuel Douzery. Phylogenetic relationships of artiodactyls and cetaceans as deduced from the comparison of cytochrome b and 12S rRNA mitochondrial sequences. „Molecular Biology and Evolution”. 14 (5), s. 550-9, 1997. DOI: 10.1093/oxfordjournals.molbev.a025792. PMID: 9159933. (ang.).
- ↑ a b The Early Mammals. W: Carroll L. Fenton, Pat V. Rich, Mildred A. Fenton, Thomas H. V. Rich: The Fossil Book: A Record of Prehistoric Life. Dover Publishing, 1996, s. 547–548. ISBN 978-0-486-29371-4.
- ↑ Robert J Asher & Kristofer M Helgen. Nomenclature and placental mammal phylogeny. „BMC Evolutionary Biology”. 10, s. 102, 2010. (ang.).
- ↑ Ulfur Arnason, Anette Gullberg, Solveig Gretarsdottir, Bjo¨rn Ursing, Axel Janke. The Mitochondrial Genome of the Sperm Whale and a New Molecular Reference for Estimating Eutherian Divergence Dates. „Journal of Molecular Evolution”. 50, s. 569–578, 2000. researchgate. DOI: 10.1007/s002390010060. (ang.).
- ↑ a b Peter J. Waddell, Norihiro Okada, Masami Hasegawa. Towards resolving the interordinal relationships of placental mammals.. „Systematic Biology”. 48 (1), s. 1-5, 1999. Society of Systematic Biologists. ISSN 1076-836X. (ang.).
- ↑ a b c J.G.M. Thewissen, Cooper, Lisa Noelle, Clementz, Mark T., Bajpai, Sunil i inni. Whales originated from aquatic artiodactyls in the Eocene epoch of India. „Nature”. 450 (7173), s. 1190–1194, 2007. DOI: 10.1038/nature06343. PMID: 18097400. Bibcode: 2007Natur.450.1190T.
- ↑ a b Northeastern Ohio Universities Colleges of Medicine and Pharmacy: Whales Descended From Tiny Deer-like Ancestors. ScienceDaily, 2007. [dostęp 2007-12-21].
- ↑ a b University Of California, Berkeley (2005, February 7): UC Berkeley, French Scientists Find Missing Link Between The Whale And Its Closest Relative, The Hippo. [dostęp 2007-12-21].
- ↑ University Of Michigan: New Fossils Suggest Whales And Hippos Are Close Kin. 2001. [dostęp 2007-12-21].
- ↑ Ian Sample: Whales may be descended from a small deer-like animal. 2007. [dostęp 2007-12-21].
- ↑ Philip D. Gingerich, D.E. Russell. Pakicetus inachus, a new archaeocete (Mammalia, Cetacea) from the early-middle Eocene Kuldana Formation of Kohat (Pakistan). „Contributions from the Museum of Paleontology”. 25, s. 235–246, 1981. [dostęp 2017-08-28].
- ↑ a b Peter Castro, Michael E. Huber: Marine Biology. Wyd. 4. McGraw-Hill, 2003.
- ↑ a b c d e f g h i j k l m n J.G.M. Thewissen, Sunhil Bajpai. Whale Origins as a Poster Child for Macroevolution. „BioScience”. 51 (12), s. 1037, 2001. DOI: 10.1641/0006-3568(2001)051[1037:WOAAPC]2.0.CO;2.
- ↑ Mark Uhen. The Origin(s) of Whales. „Annual Review of Earth and Planetary Sciences”. 38, s. 189–219, 2010. DOI: 10.1146/annurev-earth-040809-152453. Bibcode: 2010AREPS..38..189U.
- ↑ a b c d e Sirpa Nummela, Thewissen, J. G. M., Bajpai, Sunil, Hussain, S. Taseer i inni. Eocene evolution of whale hearing. „Nature”. 430 (7001), s. 776–778, 2004. DOI: 10.1038/nature02720. PMID: 15306808. Bibcode: 2004Natur.430..776N.
- ↑ Lisa N. Cooper, J.G.M. Thewissen, S.T. Hussain. New Middle Eocene Archaeocetes (Cetacea: Mammalia) from the Kuldana Formation of Northern Pakistan. „Journal of Vertebrate Paleontology”. 29 (4), s. 1289–1299, 2009. DOI: 10.1671/039.029.0423.
- ↑ a b c d J. G. M. Thewissen, E. M. Williams, L. J. Roe, S. T. Hussain. Skeletons of terrestrial cetaceans and the relationship of whales to artiodactyls. „Nature”. 413 (6853), s. 277–281, 2001. DOI: 10.1038/35095005. PMID: 11565023. Bibcode: 2001Natur.413..277T.
- ↑ J.G.M. Thewissen, S.T. Hussain, M. Alif. Fossil Evidence for the Origin of Aquatic Locomotion in Archaeocete Whales. „Science”. 263 (5144), s. 210–212, 1994. DOI: 10.1126/science.263.5144.210. PMID: 17839179. Bibcode: 1994Sci...263..210T.
- ↑ J.G.M. Thewissen, F.E. Fish, Locomotor Evolution in the Earliest Cetaceans: Functional Model, Modern Analogues, and Paleontological Evidence, „Paleobiology”, 23, 1997, s. 482–490, DOI: 10.1017/S0094837300019850, JSTOR: 2401132.
- ↑ Konami Ando, Shin-ichi Fujiwara, Farewell to life on land – thoracic strength as a new indicator to determine paleoecology in secondary aquatic mammals, „Journal of Anatomy”, 6, 229, 2016, s. 768–777, DOI: 10.1111/joa.12518.
- ↑ a b c d e f g h R E Fordyce, Barnes, L G. The Evolutionary History of Whales and Dolphins. „Annual Review of Earth and Planetary Sciences”. 22 (1), s. 419–455, 1994. DOI: 10.1146/annurev.ea.22.050194.002223. Bibcode: 1994AREPS..22..419F.
- ↑ a b F. Spoor, Bajpai, S., Hussain, S. T., Kumar, K. i inni. Vestibular evidence for the evolution of aquatic behaviour in early cetaceans. „Nature”. 417 (6885), s. 163–166, 2002. DOI: 10.1038/417163a. PMID: 12000957. Bibcode: 2002Natur.417..163S.
- ↑ a b c d e f Mickaël J. Mourlam & Maeva J. Orliac. Infrasonic and Ultrasonic Hearing Evolved after the Emergence of Modern Whales. „Current Biology”. 27, s. 1776–1781, 2017. DOI: 10.1016/j.cub.2017.04.061. (ang.).
- ↑ a b c Mark D. Uhen. New Protocetid Whales from Alabama and Mississippi, and a New Cetacean Clade, Pelagiceti. „Journal of Vertebrate Paleontology”. 28 (3), s. 589-593, 2008. Society of Vertebrate Paleontology. (ang.).
- ↑ P.D. Gingerich i inni, New Protocetid Whale from the Middle Eocene of Pakistan: Birth on Land, Precocial Development, and Sexual Dimorphism, „PLoS ONE”, 4 (2), 2009, e4366, DOI: 10.1371/journal.pone.0004366, PMID: 19194487, PMCID: PMC2629576, Bibcode: 2009PLoSO...4.4366G.
- ↑ Structural Adaptations of Early Archaeocete Long Bones. W: Sandra I. Madar, J.G.M Thewissen: The Emergence of Whales. T. 1. 1998, s. 353–378, seria: Advances in Vertebrate Paleobiology. DOI: 10.1007/978-1-4899-0159-0_12.
- ↑ P.D. Gingerich i inni, Origin of whales from early artiodactyls: hands and feet of Eocene Protocetidae from Pakistan, „Science”, 293 (5538), 2001, s. 2239–2242, DOI: 10.1126/science.1063902, PMID: 11567134.
- ↑ a b Felix G. Marx, Olivier Lambert, Mark D. Uhen: Cetacean Paleobiology. John Wiley and Sons, 2016. ISBN 978-111-856127-0.
- ↑ Alexandra Houssaye i inni, Transition of Eocene Whales from Land to Sea: Evidence from Bone Microstructure, „PLoS ONE”, 10 (2), 2015, e0118409, DOI: 10.1371/journal.pone.0118409, PMID: 25714394, PMCID: PMC4340927.
- ↑ John N. Wilford: Whales’ hind feet show up in fossils. 1990. [dostęp 2016-03-01].
- ↑ Atzcalli Ehécatl Hernández-Cisnerosa & Cheng-Hsiu Tsaib. A possible enigmatic kekenodontid (Cetacea, Kekenodontidae) from the Oligocene of Mexico. „Paleontologia Mexicana”. 5 (2), s. 147-155, 2016. (ang.).
- ↑ M. Nikaido, F. Matsuno, Retroposon analysis of major cetacean lineages: The monophyly of toothed whales and the paraphyly of river dolphins, „Proceedings of the National Academy of Sciences of the United States of America”, 98 (13), 2001, s. 7384–7389, DOI: 10.1073/pnas.121139198, PMID: 11416211, PMCID: PMC34678, Bibcode: 2001PNAS...98.7384N.
- ↑ a b c d Olivier Lambert, Manuel Martínez-Cáceres, Giovanni Bianucci, Claudio Di Celma, Rodolfo Salas-Gismondi, Etienne Steurbaut, Mario Urbina, Christian de Muizon. Earliest mysticete from the Late Eocene of Peru sheds new light on the origin of baleen whales. „Current Biology”. 27 (10), s. 1535–1541, 2017. DOI: 10.1016/j.cub.2017.04.026. (ang.).
- ↑ a b c d e f g h i j k l Felix G. Marx, R. Ewan Fordyce, Baleen boom and bust: a synthesis of mysticete phylogeny, diversity and disparity, „Royal Society Open Science”, 2 (4), 2015, s. 140434, DOI: 10.1098/rsos.140434 (ang.).
- ↑ Graham J. Slater, Jeremy A. Goldbogen, Nicholas D. Pyenson, Independent evolution of baleen whale gigantism linked to Plio-Pleistocene ocean dynamics, „Proceedings of the Royal Society B”, 284 (1855), 2017, s. 20170546, DOI: 10.1098/rspb.2017.0546 (ang.).
- ↑ Mette Elstrup Steeman. Cladistic analysis and a revised classification of fossil and recent mysticetes. „Zoological Journal of the Linnean Society”. 150 (4), s. 875–894, 2007. (ang.).
- ↑ Jonathan H. Geisler, Robert W. Boessenecker, Mace Brown, Brian L. Beatty. The origin of filter feeding in whales. „Current Biology”. 27 (13), s. 2036–2042, 2017. DOI: 10.1016/j.cub.2017.06.003. (ang.).
- ↑ David P. Hocking, Felix G. Marx, Erich M. Fitzgerald, Alistair R. Evans. Ancient whales did not filter feed with their teeth. „Biology Letters”. 13 (8). s. 20170348. DOI: 10.1098/rsbl.2017.0348. (ang.).
- ↑ a b c d e f Thomas A. Deméré, Michael R. McGowen, Annalisa Berta, John Gatesy. Morphological and Molecular Evidence for a Stepwise Evolutionary Transition from Teeth to Baleen in Mysticete Whales. „Systematic Biology”. 57 (1), s. 15–37, 2008. DOI: 10.1080/10635150701884632. PMID: 18266181. (ang.).
- ↑ PW Arnold, RA Birtles, S Sobtzick et al. Gulping behaviour in rorqual whales: underwater observations and functional interpretation. „Memoirs of the Queensland Museum”. 51, s. 309-332, 2005. [dostęp 2018-08-31]. (ang.).
- ↑ Jeremy A. Goldbogen, John Calambokidis, Robert E. Shadwick, Erin M. Oleson, Mark A. McDonald, John A. Hildebrand. Kinematics of foraging dives and lunge-feeding in fin whales. „Journal of Experimental Biology”. 209, s. 1231-1244, 2006. DOI: 10.1242/jeb.02135. (ang.).
- ↑ Erich M.G. Fitzgerald, Archaeocete-like jaws in a baleen whale, „Biology Letters”, 8 (1), 2012, s. 94–96, DOI: 10.1098/rsbl.2011.0690, PMID: 21849306, PMCID: PMC3259978.
- ↑ R.W. Meredith, J. Gatesy. Pseudogenization of the tooth gene enamelysin (MMP20) in the common ancestor of extant baleen whales. „Proceedings of the Royal Society B”. 278 (1708), s. 993–1002, 2011. DOI: 10.1098/rspb.2010.1280.
- ↑ R. E. Fordyce, Felix G. Marx. The pygmy right whale Caperea marginata: the last of the cetotheres. „Proceedings of the Royal Society B”. 280 (1753), s. 20122645, 2012. DOI: 10.1098/rspb.2012.2645. PMID: 23256199. PMCID: PMC3574355.
- ↑ Michelangelo Bisconti, Olivier Lambert, Mark Bosselaers. Taxonomic revision of Isocetus depauwi (Mammalia, Cetacea, Mysticeti) and the phylogenetic relationships of archaic ‘cetothere’ mysticetes. „Palaeontology”. 56 (1), s. 95–127, 2013. DOI: 10.1111/j.1475-4983.2012.01168.x.
- ↑ Jonathan H Geisler, Michael R McGowen, Guang Yang & John Gatesy. A supermatrix analysis of genomic, morphological, and paleontological data from crown Cetacea. „BMC Evolutionary Biology”. 11, s. 112, 2011. DOI: 10.1186/1471-2148-11-112. (ang.).
- ↑ Thomas A. Deméré, Annalisa Berta & Michael R. McGowen. The Taxonomic and Evolutionary History of Fossil and Modern Balaenopteroid Mysticetes. „Journal of Mammalian Evolution”. 12, s. 99-143, 2005. DOI: 10.1007/s10914-005-6944-3. (ang.).
- ↑ Joseph J. El Adli, Thomas A. Deméré, Robert W. Boessenecker. Herpetocetus morrowi (Cetacea: Mysticeti), a new species of diminutive baleen whale from the Upper Pliocene (Piacenzian) of California, USA, with observations on the evolution and relationships of the Cetotheriidae. „Zoological Journal of the Linnean Society”. 170 (2), s. 400–466, 2014. (ang.).
- ↑ Michaelangelo Bisconti. Comparative osteology and phylogenetic relationships of Miocaperea pulchra, the first fossil pygmy right whale genus and species (Cetacea, Mysticeti, Neobalaenidae). „Zoological Journal of the Linnean Society”. 166, s. 876–911, 2012. (ang.).
- ↑ Mette E. Steeman i inni, Radiation of extant cetaceans driven by restructuring of the oceans, „Systematic Biology”, 58 (6), 2009, s. 573–585, DOI: 10.1093/sysbio/syp060, PMID: 20525610, PMCID: PMC2777972.
- ↑ Alexander J.P. Houben i inni, Reorganization of Southern Ocean plankton ecosystem at the onset of Antarctic glaciation, „Science”, 340 (6130), 2013, s. 341–344, DOI: 10.1126/science.1223646, PMID: 23599491.
- ↑ a b F.C. Whitmore, Jr., A.E. Sanders. Review of the Oligocene Cetacea. „Systematic Zoology”. 25 (4), s. 304–320, 1976. DOI: 10.2307/2412507.
- ↑ a b NK Symeonidis, E Kazár, SJ Roussiakis. Shark-toothed dolphin remains (Mammalia, Cetacea, Squalodontidae) from the Early Miocene of Greece. „Annalen des Naturhistorischen Museums in Wien. Serie A für Mineralogie und Petrographie, Geologie und Paläontologie, Anthropologie und Prähistorie”, s. 307-331, 2003. (ang.).
- ↑ Bruno Cahuzac, Sébastien Buisson, Michel Pommiès, Philippe Rocher. Découverte de deux dents de Squalodon (Cetacea Odontoceti) dans le Burdigalien du SW de la France (Martillac, Léognan). Considérations sur les Squalodon d’Aquitaine, la paléoécologie de leurs gisements et l’espèce type du genre. „Neues Jahrbuch für Geologie und Paläontologie – Abhandlungen”. 238 (3), s. 413–451, 2005. DOI: 10.1127/njgpa/238/2006/413. (fr.).
- ↑ Olivier Lambert, Giovanni Bianucci & Mario Urbina. Huaridelphis raimondii, a new early Miocene Squalodelphinidae (Cetacea, Odontoceti) from the Chilcatay Formation, Peru. „Journal of Vertebrate Paleontology”. 34, s. 987-1004, 2014. DOI: 10.1080/02724634.2014.858050. (ang.).
- ↑ Sirpa Nummela, J.G.M. Thewissen, Sunil Bajpai, S. T. Hussain i inni. Eocene evolution of whale hearing. „Nature”. 430 (7001), s. 776–778, 2004. DOI: 10.1038/nature02720. PMID: 15306808. Bibcode: 2004Natur.430..776N.
- ↑ Rachel A. Racicot, Thomas A. Deméré, Brian L. Beatty, Robert W. Boessenecker. Unique Feeding Morphology in a New Prognathous Extinct Porpoise from the Pliocene of California. „Current Biology”. 24 (7), s. 774–779, 2014. DOI: 10.1016/j.cub.2014.02.031. PMID: 24631245.
- ↑ Gaskin, David E.: Macdonald, D.: The Encyclopedia of Mammals. New York: Facts on File, 1984, s. 196–199. ISBN 0-87196-871-1.
- ↑ Barnes, Lawrence G: Fossil odontocetes (Mammalia: Cetacea) from the Almejas Formation, Isla Cedros, Mexico. University of California, Museum of Paleontology, s. 46.
- ↑ L. G Barnes, Outline of Eastern North Pacific Fossil Cetacean Assemblages, „Systematic Zoology”, 4, 25, 1977, s. 321–343, DOI: 10.2307/2412508, JSTOR: 2412508.
- ↑ Perrin, William F., Würsig, Bernd G., Thewissen, J. G. M.: Encyclopaedia of marine mammals. Wyd. 2. Academic Press, 2009, s. 214. ISBN 978-0-12-373553-9.
- ↑ Antonella Cinzia Marra, Giuseppe Carone & Giovanni Bianucci. Sperm whale teeth from the late Miocene of Cessaniti (Southern Italy). „Bollettino della Società Paleontologica Italiana”. 55 (3), s. 223-225, 2016. (ang.).
- ↑ a b Bianucci, G., Landini, W. Killer sperm whale: a new basal physeteroid (Mammalia, Cetacea) from the Late Miocene of Italy. „Zoological Journal of the Linnean Society”. 148 (1), s. 103–131, 2006. DOI: 10.1111/j.1096-3642.2006.00228.x.
- ↑ Brian Switek: Sperm whales: a long and vicious history. [dostęp 2015-08-12].
- ↑ a b Giovanni Bianucci, Klaas Post, Olivier Lambert. Beaked whale mysteries revealed by seafloor fossils trawled off South Africa. „South African Journal of Science”. 104 (3-4), s. 140–142, 2008. [dostęp 2017-09-01].
- ↑ Giovanni Bianucci, Ismael Miján, Olivier Lambert, Klaas Post i inni. Bizarre fossil beaked whales (Odontoceti, Ziphiidae) fished from the Atlantic Ocean floor off the Iberian Peninsula. „Geodiversitas”. 35 (1), s. 105–153, 2013. DOI: 10.5252/g2013n1a6.
- ↑ a b J.G.M. Thewissen, Lisa N. Cooper, John C. George, Sunil Bajpai. From Land to Water: the Origin of Whales, Dolphins, and Porpoises. „Evolution: Education and Outreach”. 2 (2), s. 272–288, 2009. DOI: 10.1007/s12052-009-0135-2.
- ↑ J.G.M. Thewissen, E.M. Williams, L.J. Roe, S.T. Hussain. Skeletons of terrestrial cetaceans and the relationship of whales to artiodactyls. „Nature”. 413 (6853), s. 277–281, 2001. DOI: 10.1038/35095005. PMID: 11565023.
- ↑ a b L. Bejder. Limbs in whales and limblessness in other vertebrates: mechanisms of evolutionary and developmental transformation and loss. „Evolution and Development”. 4, s. 445–458, 2002. DOI: 10.1046/j.1525-142X.2002.02033.x. PMID: 12492145.
- ↑ a b J.G.M. Thewissen i inni, Developmental basis for hind-limb loss in dolphins and origin of the cetacean bodyplan, „Proceedings of the National Academy of Sciences of the United States of America”, 103 (22), 2006, s. 8414–8418, DOI: 10.1073/pnas.0602920103, PMID: 16717186, PMCID: PMC1482506.
- ↑ Lars Bejder, Brian K. Hall. Limbs in whales and limblessness in other vertebrates: mechanisms of evolutionary and developmental transformation and loss. „Evolution Development”. 4 (6), s. 445–458, 2002. DOI: 10.1046/j.1525-142X.2002.02033.x. PMID: 12492145.
- ↑ a b Pavel Gol’din. Naming an Innominate: Pelvis and Hindlimbs of Miocene Whales Give an Insight into Evolution and Homology of Cetacean Pelvic Girdle. „Evolutionary Biology”. 41 (3), s. 473–479, 2014. DOI: 10.1007/s11692-014-9281-8.
- ↑ Onbe Kaori i inni, Sequence Variation in the Tbx4 Gene in Marine Mammals, „Zoological Science”, 5, 24, 2007, s. 449–464, DOI: 10.2108/zsj.24.449, PMID: 17867844.
- ↑ Yuko Tajima, Hayashi Yoshihiro, Yamada Tadasu. Comparative Anatomical Study on the Relationships between the Vestigial Pelvic Bones and the Surrounding Structures of Finless Porpoises. „The Journal of Veterinary Medicine”. 66 (7), s. 761–766, 2004. DOI: 10.1292/jvms.66.761. PMID: 15297745.
- ↑ Principles of Biology. W: Arthur T. Johnson: Biology for Engineers. 2011, s. 227. ISBN 978-1-4200-7763-6.
- ↑ Maya Yamato, Nicholas D. Pyenson, Early Development and Orientation of the Acoustic Funnel Provides Insight into the Evolution of Sound Reception Pathways in Cetaceans, „PLoS ONE”, 3, 10, 2015, e0118582, DOI: 10.1371/journal.pone.0118582, PMID: 25760328, PMCID: PMC4356564, Bibcode: 2015PLoSO..1018582Y.
- ↑ E.M. Patterson, J. Mann, The ecological conditions that favor tool use and innovation in wild bottlenose dolphins (''Tursiops'' sp.), „PLoS ONE”, 6 (7), 2011, e22243, DOI: 10.1371/journal.pone.0022243, PMID: 21799801, PMCID: PMC3140497, Bibcode: 2011PLoSO...622243P.
- ↑ a b c d e f M. Cantor, H. Whitehead, The interplay between social networks and culture: theoretically and among whales and dolphins, „Philosophical Transactions of the Royal Society B: Biological Sciences”, 368 (1618), 2013, s. 20120340, DOI: 10.1098/rstb.2012.0340, PMID: 23569288, PMCID: PMC3638443.
- ↑ a b Michael Krützen i inni, Cultural transmission of tool use by Indo-Pacific bottlenose dolphins (''Tursiops'' sp.) provides access to a novel foraging niche, „Proceedings of the Royal Society B: Biological Sciences”, 281 (1784), 2014, s. 20140374, DOI: 10.1098/rspb.2014.0374, PMID: 24759862, PMCID: PMC4043097.
- ↑ a b Celine H. Frère i inni, Social and genetic interactions drive fitness variation in a free-living dolphin population, „Proceedings of the National Academy of Sciences of the United States of America”, 107 (46), 2010, s. 19949–19954, DOI: 10.1073/pnas.1007997107, PMID: 21041638, PMCID: PMC2993384.
- ↑ a b M.A. Stanton, J. Mann, Early Social Networks Predict Survival in Wild Bottlenose Dolphins, „PLoS ONE”, 7 (10), 2012, e47508, DOI: 10.1371/journal.pone.0047508, PMID: 23077627, PMCID: PMC3471847, Bibcode: 2012PLoSO...747508S.
- ↑ Ana R. Amaral i inni, Hybrid speciation in a marine mammal: the clymene dolphin (''Stenella clymene''), „PLoS One”, 9 (1), 2014, e83645, DOI: 10.1371/journal.pone.0083645, PMID: 24421898, PMCID: PMC3885441.
- ↑ Charles Choi: DNA Discovery Reveals Surprising Dolphin Origins. 2014. [dostęp 2016-01-02].
- ↑ W.F. Perrin, E.D. Mitchell, J.G. Mead, D.K. Caldwell i inni. Stenella clymene, a Rediscovered Tropical Dolphin of the Atlantic. „Journal of Mammalogy”. 62 (3), s. 583–598, 1981. DOI: 10.2307/1380405. JSTOR: 1380405.
- ↑ Charles Q. Choi: DNA Discovery Reveals Surprising Dolphin Origins. [w:] National Geographic [on-line]. 2014. [dostęp 2016-01-20].
- ↑ Xuming Zhou i inni, Baiji genomes reveal low genetic variability and new insights into secondary aquatic adaptations, „Nature Communications”, 4, 2013, s. 2708, DOI: 10.1038/ncomms3708, PMID: 24169659, PMCID: PMC3826649.
- ↑ A.E. Moura, A. Natoli, E. Rogan, A.R. Hoelzel. Atypical panmixia in a European dolphin species (Delphinus delphis): implications for the evolution of diversity across oceanic boundaries. „Journal of Evolutionary Biology”. 26 (1), s. 63–75, 2012. DOI: 10.1111/jeb.12032. PMID: 23205921.
- ↑ G. Bearzi, C. Fortuna, R. Reeves, Tursiops truncatus Mediterranean subpopulation, [w:] The IUCN Red List of Threatened Species, DOI: 10.2305/IUCN.UK.2012-1.RLTS.T16369383A16369386.en [dostęp 2021-02-14] (ang.).
- ↑ A.E. Moura i inni, Recent Diversification of a Marine Genus (''Tursiops'' spp.) Tracks Habitat Preference and Environmental Change, „Systematic Biology”, 6, 62, 2013, s. 865–877, DOI: 10.1093/sysbio/syt051, PMID: 23929779.
- ↑ M. Louis i inni, Habitat-driven population structure of bottlenose dolphins, ''Tursiops truncatus'', in the North-East Atlantic, „Molecular Ecology”, 4, 23, 2014, s. 857–874, DOI: 10.1111/mec.12653, PMID: 24383934.
- ↑ G. Minton, G. Braulik, R. Reeves, Globicephala macrorhynchus, [w:] The IUCN Red List of Threatened Species, DOI: 10.2305/IUCN.UK.2011-2.RLTS.T9249A12972356.en [dostęp 2021-02-14] (ang.).
- ↑ Amano M. みちのくの海のイルカたち(特集 みちのくの海と水族館の海棲哺乳類). „Isana 56”, s. 60–65, 2012. Faculty of Fisheries of University of Nagasaki, Isanakai. [dostęp 2017-08-28]. (jap.).
- ↑ Hidaka T, Kasuya T, Izawa K, Kawamichi. 1996. The encyclopaedia of animals in Japan (2) – Mammals 2. ISBN 978-4-582-54552-4 (ISBN 978-4-582-54551-7, ISBN 4-582-54552-1). Heibonsha.
Bibliografia
edytuj- Douglas J. Futuyma: Ewolucja. Warszawa: Wydawnictwa Uniwersytetu Warszawskiego, 2008. ISBN 978-83-235-0577-8.