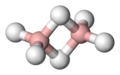
Diboran
Diboran, B2H6 – nieorganiczny związek chemiczny, dimer borowodoru. Jest wysoce reaktywny, z powietrzem tworzy mieszaninę wybuchową, łatwo ulega samozapłonowi pod wpływem wilgoci. Ciśnienie pary nasyconej wynosi 28 bar (0 °C).
| |||||||||||||||||||||||||||||||||||||||||||||||||||

| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
B2H6 | ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
(BH3)2 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa molowa |
27,67 g/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd |
bezbarwny gaz | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||||||||||||
Struktura
edytujW diboranie występują trójcentrowe-dwuelektronowe wiązania B−H−B, w których odległość B−H (131 pm) jest znacząco większa niż w konwencjonalnych terminalnych wiązaniach B−H (119 pm). Struktura ta została zaproponowana w 1921 roku przez W. Dithleya[4], lecz rozpowszechniona została dopiero w latach 40. XX wieku[5], budząc początkowo wątpliwości, m.in. ze strony Linusa Paulinga[6].
Zastosowanie
edytujDiboran znajduje wiele zastosowań w preparatyce chemicznej[7]. Wykorzystywany jako reagent do otrzymywania organicznych i nieorganicznych związków boru, reduktor, katalizator, paliwo rakietowe i in.
Jest ważnym odczynnikiem w syntezie organicznej. Ulega addycji do alkenów tworząc alkiloborany, które łatwo utleniają się H2O2 w środowisku alkalicznym do alkoholi. Podobnie reaguje z alkinami, dając aldehydy jako produkty końcowe. Borowodór jest również używany jako reduktor w reakcji z kwasami karboksylowymi, redukując je do pierwszorzędowych alkoholi.
Otrzymywanie
edytujDiboran otrzymuje się ilościowo w eterze, w temperaturze pokojowej, w reakcji borowodorku sodu z fluorkiem boru[8]:
- 3NaBH4 + 4BF3 → 2B2H6 + 3NaBF4
Na skalę przemysłową diboran otrzymuje się w wyniku wysokotemperaturowej redukcji fluorku boru wodorkiem sodu[8]:
- 2BF3 + 6NaH → B2H6 + 6NaF
Przypisy
edytuj- ↑ a b c d e f g h Diborane, [w:] GESTIS-Stoffdatenbank [online], Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, ZVG: 570112 [dostęp 2012-02-07] (niem. • ang.).
- ↑ a b Diboran (nr 463051) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2012-02-07]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Diboran (nr 463051) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Stanów Zjednoczonych. [dostęp 2017-01-20]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ W. Dithley. „Angewandte Chemie”. 34, s. 596, 1921.
- ↑ Robert S. Mulliken. The Structure of Diborane and Related Molecules. „Chem. Rev.”. 47 (2), s. 207–217, 1947. DOI: 10.1021/cr60129a002. (ang.).
- ↑ P. Laslo. A Diborane Story. „Angewandte Chemie International Edition”. 39, s. 2071–2072, 2000. DOI: <2071::AID-ANIE2071>3.0.CO;2-C 10.1002/1521-3773(20000616)39:12<2071::AID-ANIE2071>3.0.CO;2-C.
- ↑ B.M. Mikhailov. The Chemistry of Diborane. „Russian Chemical Review”. 31, s. 207–224, 1962.
- ↑ a b F.A. Cotton, G Wilkinson, P.L. Gaus, Chemia nieorganiczna, Warszawa: Wydawnictwo Naukowe PWN, 1995, ISBN 83-01-11772-9.