Kinaza pirogronianowa
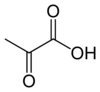
Kinaza pirogronianowa (EC 2.7.1.40) – enzym z klasy transferaz katalizujący przeniesienie grupy fosforanowej z fosfoenolopirogronianu na ADP, przez co tworzy się jedna cząsteczka pirogronianu i jedna cząsteczka ATP[1]:

Reakcja ta bierze udział w szlaku glikolitycznym.
Glikoliza
edytujReakcja katalizowana przez kinazę pirogronianową jest finalnym etapem w glikolizie, dzięki któremu tworzony jest pirogronian – ostateczny produkt glikolityczny u tlenowców. Jednakże beztlenowce przeprowadzają dodatkową reakcję. Dehydrogenaza mleczanowa wykorzystuje NADH, wyprodukowany przez dehydrogenazę aldehydu 3-fosfoglicerynowego, by zredukować pirogronian do mleczanu.
Izozymy
edytujLudzie posiadają dwa izozymy kinazy pirogronianowej.
- typ M (mięśnie)
- typ L,R (wątroba i erytrocyty)
Izozymy różnią się od siebie strukturą pierwszorzędową oraz sposobami regulacji.
Regulacja
edytujReakcja ma ujemny potencjał zamiany energii swobodnej, podobnie jak dwie inne w glikolizie. Te trzy reakcje – fosforylacja glukozy, fosforylacja fruktozo-6-fosforanu oraz odłączenie grupy fosforanowej z fosfoenolopirogronianu – regulują ogólną aktywność szlaku glikolitycznego, i są generalnie nieodwracalne w warunkach fizjologicznych[2].
Aktywność kinazy pirogronianowej jest regulowana przez[2][3]:
- substrat, fosfoenolopirogronian oraz fruktozo-1,6-bisfosforan, intermediat w procesie glikolizy; dlatego też, glikoliza przebiega szybciej, gdy jest obecna większa ilość substratu
- ilość ATP, który jest inhibitorem allosterycznym; podobnie przebiega regulacja w fosfofruktokinazie I
- acetylo-CoA (aktywator allosteryczny[4]), podwyższony poziom acetylo~S-CoA wskazuje na potrzebę wzmożenia syntezy szczawiooctanu
- alaninę, ujemny modulator allosteryczny.
Wątrobowa kinaza pirogronianowa jest także regulowana pośrednio poprzez adrenalinę oraz glukagon, które wywierają swoje działanie na kinazie białkowej A. Kinaza białkowa fosforyluje wątrobową kinazę pirogronianową, dezaktywując ją. Mięśniowa kinaza pirogronianowa nie jest wrażliwa na kinazę białkową A, aktywowaną adrenaliną. Obecność glukagonu sygnalizuje głód, tzn. niski poziom glukozy. Wzrost stężenia cukru we krwi prowadzi do wydzielenia insuliny, która aktywuje fosfatazę fosfoprotein typu I, co w konsekwencji prowadzi do defosforylacji kinazy pirogronianowej, dzięki czemu jest znowu aktywna. Taka kontrola zapobiega jednoczesnej aktywności kinazy pirogronianowej oraz enzymów katalizujących odwrotną reakcję (karboksylaza pirogronianowa oraz karboksykinaza fosfoenolopirogronianowa).
Niedobór
edytujMutacje w planie budowy tego enzymu powodują schorzenie pod postacią deficytu kinazy pirogronianowej. Skutkuje to bardzo spowolnionym tempem przebiegu glikolizy. Jest to szczególnie niszczące dla komórek pozbawionych mitochondriów, ponieważ komórki te wykorzystują proces glikolizy jako ich jedyne źródło energii, gdyż cykl Krebsa jest niemożliwy dla nich do przeprowadzenia[5][niewiarygodne źródło?][6].
Przykładem mogą być krwinki czerwone, u których brak/niedobór kinazy pirogronianowej prowadzi do szybkiego wyczerpania zasobów ATP, przez co może wystąpić hemoliza. Dlatego też, deficyt tego enzymu może skutkować w pojawieniu się niedokrwistości hemolitycznej[7].
Glukoneogeneza
edytujKinaza pirogronianowa jest także enzymem regulatorowym w procesie glukoneogenezy, szlaku metabolicznego przebiegającego w wątrobie i polegającego na przekształcaniu pirogronianu i innych substancji w glukozę. Kiedy kinaza pirogronianowa jest dezaktywowana poprzez fosforylację (co ma miejsce podczas głodu, na skutek działania glukagonu), fosfoenolopirogronian nie może być przekształcany do pirogronianu. Jest on natomiast konwertowany do glukozy na drodze glukoneogenezy. Powstała wówczas glukoza jest wydalana z wątroby i rozprowadzana po organizmie, do tkanek, które potrzebują energii w stanie głodu.
Zobacz też
edytujPrzypisy
edytuj- ↑ KEGG reaction: pyruvate kinase
- ↑ a b Regulation of glycolysis. [dostęp 2009-09-01]. [zarchiwizowane z tego adresu (2009-03-03)].
- ↑ Lubert Stryer, Biochemia, wyd. 4, PWN, 2003, s. 527 i następne, s. 611 i następne (pol.).
- ↑ Bańkowski, Edward, 1942-, Biochemia. Podręcznik dla studentów uczelni medycznych, wyd. 2, Wrocław: Elsevier Urban & Partner, 2010, ISBN 978-83-7609-041-2, OCLC 751024707.
- ↑ Niedobór kinazy pirogronianowej nowotworowe.pl
- ↑ E.C. Gordon-Smith, Pyruvate kinase deficiency, „Journal of Clinical Pathology”, s3-8 (1), 1974, s. 128–133, DOI: 10.1136/jcp.s3-8.1.128, ISSN 0021-9746 [dostęp 2019-05-31] (ang.).
- ↑ Rachael F. Grace i inni, Erythrocyte pyruvate kinase deficiency: 2015 status report, „American Journal of Hematology”, 90 (9), 2015, s. 825–830, DOI: 10.1002/ajh.24088, ISSN 0361-8609, PMID: 26087744, PMCID: PMC5053227 [dostęp 2019-05-31].
Linki zewnętrzne
edytuj- https://web.archive.org/web/20090303224811/http://cmgm.stanford.edu/biochem200/regulation/
- http://www.genome.jp/dbget-bin/www_bget?ec:2.7.1.40