Drakunkuloza
Drakunkuloza (łac. dracunculosis, ang. guinea worm disease, dracunculiasis) – choroba pasożytnicza wywoływana przez nitkowca podskórnego (Dracunculus medinensis). Dawniej występowała w wielu krajach pasa zwrotnikowego w Afryce i w Azji Środkowej, gdzie nazywano go risztą (z języka tadżyckiego: nić, nitka). Obecnie jest stwierdzana wyłącznie w kilku krajach Afryki: Sudanie Południowym, Mali, Etiopii i Czadzie. Liczba chorych spadła z około 3,5 miliona w roku 1986 do 1058 w roku 2011[1] i 22 w roku 2015[2].
| dracunculosis | |
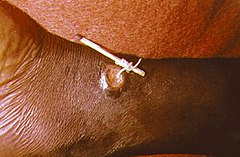 Usuwanie nitkowca podskórnego z ludzkiej kończyny za pomocą patyczka | |
| Klasyfikacje | |
| ICD-10 | |
|---|---|
| DiseasesDB | |
| MeSH | |
Drakunkuloza to choroba pasożytnicza wywołana nitkowcem podskórnym[2]. Do zarażenia u człowieka dochodzi po spożyciu wody, w której znajdują się oczliki zainfekowane larwą nitkowca podskórnego[2]. Początkowo choroba przebiega bezobjawowo[3]. Po około roku osobnik żeński pasożyta tworzy pęcherzyk na skórze, zazwyczaj na kończynie dolnej, co u chorej osoby wywołuje uczucie bolesnego pieczenia[2]. Przez następne parę tygodni pasożyt wydostaje się przez skórę[4]. W tym okresie spacerowanie lub praca mogą sprawiać problemy[3]. Uważano, że jedynie ludzie mogą się zarazić nitkowcem podskórnym[3], ale w 2012 roku stwierdzono występowanie tego pasożyta także u psów[2].
Historia
edytujDrakunkuloza znana jest od czasów starożytnych[3]. Pisano o niej w staroegipskim papirusie medycznym, tzw. Papirusie Ebersa z 1550 r. p.n.e.[5] Nazwa drakunkuloza pochodzi od łacińskiego określenia „choroba wywołana przez małe smoki”[6]. Natomiast nazwa guinea worm („robak gwinejski”) pojawiła się po tym, jak w siedemnastym wieku Europejczycy spotkali się z chorobą na wybrzeżu Gwinei w Afryce Zachodniej[5]. Gatunek podobny do nitkowca podskórnego wywołuje choroby u innych zwierząt, jednak ludzie się nim nie zarażają[7]. Klasyfikuje się ją do grupy zaniedbanych chorób tropikalnych[8].
W roku 2015 zgłoszono 22 przypadki drakunkulozy u ludzi[2]. Liczba ta spadła z 3,5 miliona przypadków odnotowanych w 1986[3]. W latach osiemdziesiątych XX wieku istniała w 20 krajach, a obecnie jedynie w 4 państwach w Afryce[2]. Jest to pierwsza choroba pasożytnicza, w przypadku której możliwe jest jej całkowite zwalczenie[9]. Przeszkodami są warunki sanitarne, oddalenie miejsc występowania od cywilizacji, konflikty zbrojne na terenach występowania choroby, a także możliwość przetrwania pasożyta w organizmie psa[2].
Cykl rozwojowy pasożyta
edytujPasożyt ma około jeden do dwóch milimetrów szerokości, a osobnik żeński dorosły ma 60 do 100 centymetrów długości (osobniki męskie są o wiele krótsze)[2][3]. Poza organizmem nosiciela jaja pasożyta mogą przeżyć trzy tygodnie[10]. Przed tym muszą zostać spożyte przez oczliki[2]. Larwy znajdujące się w oczlikach mogą przeżyć cztery miesiące[10], dlatego też każdego roku musi dojść do zarażenia, aby zapewnić przetrwanie gatunku[11].
Do zarażenia człowieka dochodzi podczas spożycia wody, w której znajdują się skorupiaki z rodzaju Cyclops. Larwy przebijają ścianę żołądka lub jelit, łączą się w pary i dojrzewają. Osobniki męskie giną, natomiast samice rosną przez około rok i w końcu lokalizują się w tkance podskórnej, najczęściej kończyn dolnych, gdzie ich długość może dochodzić do 1 metra. W skórze, w miejscu, gdzie znajduje się część przednia pasożyta, powstaje pęcherzyk, który najczęściej w przypadku kontaktu z wodą pęka i powstaje owrzodzenie, w którym widoczna jest przednia część pasożyta, a uwolnione w ten sposób larwy przedostają się do środowiska wodnego i może się rozpocząć kolejny cykl życiowy pasożyta.
Jako pierwszy cykl rozwojowy tego pasożyta zbadał i opisał ok. 1870 r. podczas podróży po Azji Środkowej młody rosyjski podróżnik i przyrodnik Aleksiej Fedczenko.
Objawy kliniczne
edytujDiagnozę choroby stawia się z reguły na podstawie objawów[12]. Do czasu zlokalizowania się pasożyta pod skórą zwykle nie występują żadne objawy. W momencie tworzenia się pęcherza w skórze występuje ból i pieczenie w jego miejscu, natomiast po jego pęknięciu przebieg jest już bezbolesny. Wokół rany może dojść do wtórnego nadkażenia i zapalenia tkanki podskórnej, wytworzenia ropnia lub ropowicy. Czasami mogą wystąpić stany gorączkowe lub objawy alergiczne (zwykle przed pęknięciem pęcherzyka z wytworzeniem owrzodzenia).
Leczenie
edytujProfilaktyka polega na wczesnym zdiagnozowaniu choroby i zapobieganiu kontaktu rany z wodą pitną[2]. Inne czynności to lepszy dostęp do czystej wody lub filtrowanie jej[2]. Często wystarczy przefiltrować wodę używając kawałka materiału[4]. Skażoną wodę pitną można potraktować substancją zwaną temefosem w celu zabicia larw[2]. Nie ma leku ani szczepionki przeciwko tej chorobie[2]. W ciągu kilku tygodni można pomału usunąć pasożyta, nawijając go na patyczek[3]. Owrzodzenia powstałe wskutek usunięcia pasożyta mogą ulec zakażeniu bakteriami[3]. Po usunięciu pasożyta ból może się jeszcze utrzymywać miesiącami[3].
Nie istnieją leki działające na dorosłe formy Dracunculus medinensis. Leki takie jak mebendazol, tiabendazol, metronidazol są mało skuteczne. Szeroko rozpowszechnione jest samodzielne usuwanie robaka poprzez nawijanie go na patyk po kilka centymetrów dziennie. W przypadku dostępności lekarza, można również dokonać chirurgicznego jego usunięcia.
Epidemiologia
edytujW 1986 stwierdzono 3,5 miliona przypadków drakunkulozy w 20 endemicznych krajach Afryki i Azji[13]. Ghana zgłosiła 180 tys. przypadków w 1989 roku. Liczba zachorowań spadła do 22 w 2015 roku[2] w 4 endemicznych krajach Afryki: Sudanie Południowym, Czadzie, Mali i Etiopii.
Organizacją zaświadczającą wyeliminowanie choroby w danym kraju lub na świecie jest Światowa Organizacja Zdrowia[14]. Informację o stanie zwalczania drakunkulozy informuje również Centrum Cartera[15].
Poniższa tabela przedstawia liczbę przypadków drakunkulozy w krajach endemicznych od 2011 roku[16]:
| Data | Sudan Południowy | Mali | Etiopia | Czad | Suma |
|---|---|---|---|---|---|
| 2011 | 1028 | 12 | 8 | 10 | 1058 |
| 2012 | 521 | 7 | 4 | 10 | 542 |
| 2013 | 113 | 11 | 7 | 14 | 148 (łącznie z trzema przypadkami zawleczonymi do Sudanu) |
| 2014 | 70 | 40 | 3 | 13 | 126 |
| 2015 | 5 | 5 | 3 | 9 | 22 |
| 2016 | 6 | 0 | 3 | 16 | 25 |
| 2017 | 0 | 0 | 15 | 15 | 30 |
| 2018[17] | 10 | 0 | 0 | 17 | 28 (jeden przypadek odnotowany w Angoli) |
| 2019 | 4 | 0 | 0 | 47 | 54 (po jednym przypadku w Angoli i Kamerunie) |
| 2020 | 1 | 1 | 11 | 12 | 27 (po jednym przypadku w Angoli i Kamerunie) |
Od 2015 do 2020 roku w Mali nie wystąpił ani jeden przypadek drakunkulozy, ale nadal jest to kraj endemiczny i w tym czasie odnotowano kilka zarażeń u psów domowych i kotów. Dostęp do służby zdrowia nadal jest tam ograniczony[17].
Przypisy
edytuj- ↑ Donald R. Hopkins. Global Health - Disease Eradication. „N Engl J Med”. 368, s. 54-63, 2013-01-03. DOI: 10.1056/NEJMra1200391.
- ↑ a b c d e f g h i j k l m n o Dracunculiasis (guinea-worm disease) Fact sheet N°359 (Revised). [w:] World Health Organization [on-line]. 2016-02. [dostęp 2016-03-12].
- ↑ a b c d e f g h i C. Greenaway. Dracunculiasis (guinea worm disease).. „CMAJ”. 170 (4), s. 495-500, 2004. PMID: 14970098.
- ↑ a b S. Cairncross, A. Tayeh, AS. Korkor. Why is dracunculiasis eradication taking so long?. „Trends Parasitol”. 28 (6), s. 225-30, czerwiec 2012. DOI: 10.1016/j.pt.2012.03.003. PMID: 22520367.
- ↑ a b Tropical Medicine Central Resource: Dracunculiasis. Uniformed Services University of the Health Sciences. [dostęp 2008-07-15]. [zarchiwizowane z tego adresu (2015-06-14)].
- ↑ Barry M. The tail end of guinea worm — global eradication without a drug or a vaccine. „N. Engl. J. Med.”. 356 (25), s. 2561–4, 2007. DOI: 10.1056/NEJMp078089. PMID: 17582064.
- ↑ Jeremy Farrar Junghanss: Manson's tropical diseases.. Wyd. 23. Oxford: Elsevier/Saunders, 2013, s. 763. ISBN 978-0-7020-5306-1.
- ↑ cdc.gov: Neglected Tropical Diseases. 2011-06-01. [dostęp 2014-11-28].
- ↑ Guinea Worm Eradication Program. [w:] The Carter Center [on-line]. Carter Center. [dostęp 2011-03-01].
- ↑ a b Jeremy Farrar Junghanss: Manson's tropical diseases.. Wyd. 23. Oxford: Elsevier/Saunders, 2013, s. e62. ISBN 978-0-7020-5306-1.
- ↑ Parasites - Dracunculiasis (also known as Guinea Worm Disease) Eradication Program. [w:] CDC [on-line]. 2013-11-22. [dostęp 2014-03-19].
- ↑ Gordon Cook: Manson's tropical diseases. Wyd. 22. Edynburg: Saunders, 2009, s. 1506. ISBN 978-1-4160-4470-3.
- ↑ Guinea Worm Eradication Program. Centrum Cartera. [dostęp 2016-12-25]. (ang.).
- ↑ WHO certifies seven more countries as free of guinea-worm disease. Światowa Organizacja Zdrowia. [dostęp 2016-12-25]. (ang.).
- ↑ Where We Work: Guinea Worm Eradication Program. Centrum Cartera. [dostęp 2016-12-25]. (ang.).
- ↑ Guinea Worm Case Totals. Centrum Cartera. [dostęp 2016-12-25]. (ang.).
- ↑ a b Guinea Worm Wanes to 28 Cases Globally; Ethiopia, Mali Report Zero Human Cases.
Bibliografia
edytuj- Inwazje i choroby pasożytnicze. W: Zbigniew Pawłowski: Choroby zakaźne i pasożytnicze. Zdzisław Dziubek (red.). Wyd. wydanie III uaktualnione. Warszawa: Wydawnictwo Lekarskie PZWL, 2003, s. 498-499. ISBN 83-200-2748-9.
Linki zewnętrzne
edytuj- Dracunculiasis. CDC Division of Parasitic Diseases. [dostęp 2007-10-18]. [zarchiwizowane z tego adresu (28 kwietnia 2007)].